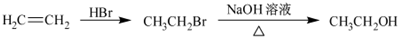题目内容
17.A、B、C、D四种元素在周期表中分别处于元素X的四周(如图)已知元素X最高价氧化物的化学式为X2O5,且五种元素中有一种元素的原子半径是它们所处的同族元素中最小的.| B | ||
| A | X | C |
| D |
(2)写出C、D、X气态氢化物最高价氧化物对应水化物的化学式,其酸性由强到弱的顺序为H2SO4>H3PO4>H3AsO4.
(3)写出A、B、X气态氢化物的化学式,其稳定性由强到弱的顺序为NH3>PH3>SiH4.
分析 (1)解答本题之关键是确定X.X2O5中X的化合价为+5,则X是VA族元素.由于五种元素中有一种元素的原子半径是它们所处的同族中最小的,这种元素只能是B.B为VA族的第一种元素N,则X为P,D为As,A为Si,C为S;
(2)(3)可根据元素的非金属性强弱比较最高价氧化物对应水化物的酸性强弱以及氢化物的稳定性.
解答 解:(1)X2O5中X的化合价为+5,则X是VA族元素.由于五种元素中有一种元素的原子半径是它们所处的同族中最小的,这种元素只能是B.B为VA族的第一种元素N,则X为P,D为As,A为Si,C为S,故答案为:Si;N;S;As;
(2)由于非金属性:S>P>As,元素的非金属性越强,对应的最高价氧化物对应水化物的酸性强越强,则有酸性:H2SO4>H3PO4>H3AsO4,故答案为:H2SO4>H3PO4>H3AsO4;
(3)元素的非金属性越强,对应的氢化物越稳定,非金属性:N>P>Si,则有稳定性:NH3>PH3>SiH4.
点评 本题主要考查的是元素的推断以及元素周期律的应用,推断得出元素X以及掌握非金属性变化规律是解决本题的关键,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
8.下列物质属于电解质的是( )
| A. | 氧气 | B. | 氯化氢 | C. | 二氧化硫 | D. | 铜 |
5.固体粉末M中可能含有Cu、FeO、Fe2O3、K2SO3、Na2CO3、KCl中的若干种.为确定该固体粉末的成分,现取M进行下列实验,实验过程及现象如下:下列有关说法正确的是( )

| A. | 气体乙中一定含有CO2可能含有SO2 | |
| B. | 白色沉淀丁一定是AgCl | |
| C. | 固体粉末M中一定含有Cu、FeO,可能含有Fe2O3 | |
| D. | 固体乙中一定含有Fe2O3和CuO |
12.下列关于胶体的认识正确的是( )
①纳米材料微粒直径一般从几纳米到几十纳米(1nm=10-9 m),因此纳米材料属于胶体
②往Fe(OH)3胶体中逐滴加入过量的硫酸会先产生沉淀而后沉淀逐渐溶解
③氢氧化铁胶体稳定存在的主要原因是胶粒带电荷
④依据丁达尔现象可将分散系分为溶液、胶体与浊液
⑤AgI胶体在电场中自由运动.
①纳米材料微粒直径一般从几纳米到几十纳米(1nm=10-9 m),因此纳米材料属于胶体
②往Fe(OH)3胶体中逐滴加入过量的硫酸会先产生沉淀而后沉淀逐渐溶解
③氢氧化铁胶体稳定存在的主要原因是胶粒带电荷
④依据丁达尔现象可将分散系分为溶液、胶体与浊液
⑤AgI胶体在电场中自由运动.
| A. | ③④⑤ | B. | ①②④ | C. | ②③ | D. | ①⑤ |
9.25℃时,下列各溶液中,离子的物质的量浓度关系正确的是( )
| A. | 饱和纯碱(Na2CO3)溶液中:2c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) | |
| B. | 1mol/L的(NH4)2SO4溶液中:c(NH4+)>c(SO42-)>c(H+)>c(OH-) | |
| C. | 0.10mol/L醋酸钠溶液中:c(Na+)+c(H+)=c(CH3COO-)+c(OH-) | |
| D. | 等体积,pH=3的盐酸和醋酸中和氢氧化钠的物质的量相同 |
6.短周期元素A、B、C、D的原子序数依次增大,它们原子的最外层电子数之和为16,A与D同主族,B+与A2-具有相同的电子层结构,C原子的最外层电子数等于A原子最外层电子数的一半,则下列叙述正确的是( )
| A. | B2A2和B2A中阴阳离子的个数比相同 | |
| B. | 原子半径的大小顺序:r(D)>r(C)>r(B)>r(A) | |
| C. | D的简单气态氢化物的热稳定性比A的强 | |
| D. | 元素C的单质是一种高硬度、高熔点的金属 |
 大麻酚及它的衍生物都属麻醉药品,并且毒性较强.吸食大麻使人的脑功能失调、记忆力消退、健忘、注意力很难集中.吸食大麻还可破坏男女的生育能力,而且由于大麻中焦油含量高,其致癌率也较高.大麻酚分子结构如图,回答下列问题:
大麻酚及它的衍生物都属麻醉药品,并且毒性较强.吸食大麻使人的脑功能失调、记忆力消退、健忘、注意力很难集中.吸食大麻还可破坏男女的生育能力,而且由于大麻中焦油含量高,其致癌率也较高.大麻酚分子结构如图,回答下列问题: .
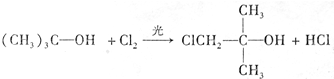
.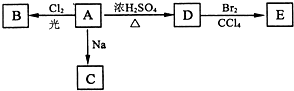
 ;A转化为D的反应的类型消去反应.
;A转化为D的反应的类型消去反应.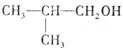 .
.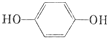 .
.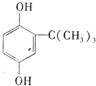 .
.
 ;
;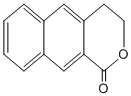 是一种重要的药物合成中间体,请结合题目所给信息,
是一种重要的药物合成中间体,请结合题目所给信息,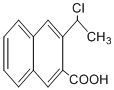 为原料制备该化合物的合成路线流程图(无机试剂任用).合成路线流程图示例如下:
为原料制备该化合物的合成路线流程图(无机试剂任用).合成路线流程图示例如下: