题目内容
14.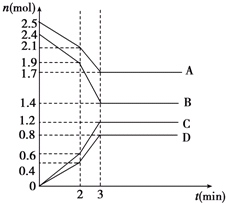 在某一容积为2L的恒容密闭容器中,A、B、C、D四种物质的物质的量n(mol)随时间t(min)的变化曲线如图所示.回答下列问题:
在某一容积为2L的恒容密闭容器中,A、B、C、D四种物质的物质的量n(mol)随时间t(min)的变化曲线如图所示.回答下列问题:(1)该反应的化学方程式为4A+5B?6C+4D.
(2)前2min内用A的浓度变化表示的化学反应速率为0.1mol/(L.min),4min时,v正(A)=(填“>”“<”或“=”)v逆(D).
(3)在2min时,图象发生改变的原因可能是c(填字母)
a.增大B的物质的量 b.降低温度 c.加入催化剂 d.减小A的物质的量.
分析 (1)根据图象知,A、B是反应物、C和D是生成物,反应达到平衡时,参加反应的物质的量变化量分别为:△n(A)=(2.5-1.7)mol=0.8mol、△n(B)=(2.4-1.4)mol=1.0mol、△n(C)=(1.2-0)mol=1.2mol、△n(D)=(0.8-0)mol=0.8mol,各物质的量的变化量之比等于其计量数之比,据此书写方程式;
(2)前2min内用A的浓度变化表示的化学反应速率=$\frac{\frac{2.5-2.1}{2}}{2}$mol/(L.min);4min时,该反应达到平衡状态,反应速率之比等于其计量数之比;
(3)在2min时,各物质的物质的量不变,相同时间内物质的量变化量增大,说明加快反应速率.
解答 解:(1)根据图象知,A、B是反应物、C和D是生成物,反应达到平衡时,参加反应的物质的量变化量分别为:△n(A)=(2.5-1.7)mol=0.8mol、△n(B)=(2.4-1.4)mol=1.0mol、△n(C)=(1.2-0)mol=1.2mol、△n(D)=(0.8-0)mol=0.8mol,各物质的量的变化量之比等于其计量数之比,所以A、B、C、D计量数之比=0.8mol:1.0mol:1.2mol:0.8mol=4:5:6:4,反应方程式为4A+5B?6C+4D,
故答案为:4A+5B?6C+4D;
(2)前2min内用A的浓度变化表示的化学反应速率=$\frac{\frac{2.5-2.1}{2}}{2}$ mol/(L.min)=0.1 mol/(L.min);4min时,该反应达到平衡状态,反应速率之比等于其计量数之比,A、D的计量数相等,所以其反应速率相等,
故答案为:0.1 mol/(L.min);=;
(3)在2min时,各物质的物质的量不变,相同时间内物质的量变化量增大,说明加快反应速率,降低温度反应速率减慢,只有加入催化剂能加快反应速率且瞬间各物质的物质的量不变,故选c.
点评 本题考查图象分析,侧重考查学生分析判断及计算能力,涉及方程式的推断、反应速率的计算及平衡影响因素判断等知识点,难点是(3)题影响因素判断,题目难度中等.

 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案
| A. | 气体乙中一定含有CO2可能含有SO2 | |
| B. | 白色沉淀丁一定是AgCl | |
| C. | 固体粉末M中一定含有Cu、FeO,可能含有Fe2O3 | |
| D. | 固体乙中一定含有Fe2O3和CuO |
| A. | 饱和纯碱(Na2CO3)溶液中:2c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) | |
| B. | 1mol/L的(NH4)2SO4溶液中:c(NH4+)>c(SO42-)>c(H+)>c(OH-) | |
| C. | 0.10mol/L醋酸钠溶液中:c(Na+)+c(H+)=c(CH3COO-)+c(OH-) | |
| D. | 等体积,pH=3的盐酸和醋酸中和氢氧化钠的物质的量相同 |
| A. | B2A2和B2A中阴阳离子的个数比相同 | |
| B. | 原子半径的大小顺序:r(D)>r(C)>r(B)>r(A) | |
| C. | D的简单气态氢化物的热稳定性比A的强 | |
| D. | 元素C的单质是一种高硬度、高熔点的金属 |
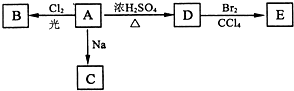
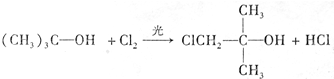 ;A转化为D的反应的类型消去反应.
;A转化为D的反应的类型消去反应.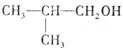 .
.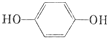 .
.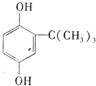 .
.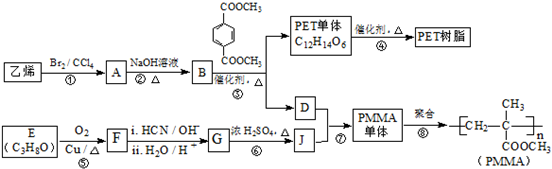
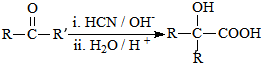 (R、R′代表烃基)
(R、R′代表烃基) .
. .
. .
.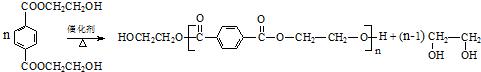 .
.