题目内容
8.錳、铬、钴、镍虽不是中学阶段常见的金属元素,但在工业生产中有着重要作用.Ⅰ.(1)自然界Cr主要以+3价和+6价存在.+6价的Cr能引起细胞的突变,可以用亚硫酸钠将其还原为+3价的铬.完成并配平下列离子方程式:
1Cr2O72-+3SO32-+8H+=2Cr3++3SO42-+4H2O
Ⅱ.某化学研究性学习小组拟从废旧干电池中回收二氧化锰制取碳酸锰.
①将干电池剖切、分选得到黑色混合物(主要成分为MnO2)洗涤、过滤、烘干.
②将上述固体按固液体积比2:9加入浓盐酸、加热,反应完全后过滤、浓缩.
③向上述溶液中加入Na2CO3溶液,边加边搅拌,再过滤即可得到碳酸锰.
(2)在第②步中,将上述固体与浓盐酸混合的目的是将MnO2还原成Mn2+,反应的离子反应方程式:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O
(3)过程②中,浓缩需要使用酒精灯、三脚架,还需要的仪器有蒸发皿、玻璃棒
Ⅲ.(4)NiSO4•6H2O是一种绿色易溶于水的晶体,广泛用于镀镍、生产电池等,可由电镀废渣(除含镍外,还含有:Cu、Zn、Fe、Cr等杂质)为原料获得.操作步骤如下:
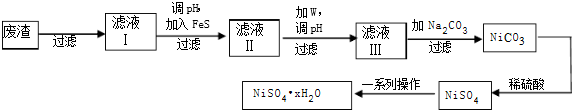
①向滤液Ⅰ中加入FeS是为了除去Cu2+、Zn2+等杂质,除去Cu2+的离子方程式为FeS(s)+Cu2+(aq)=Fe2+(aq)+CuS(s).
②对滤液Ⅱ先加W,再测pH,W最适宜的试剂是H2O2,调pH的目的是将Fe2+氧化为Fe3+除去Fe2+.
③滤液Ⅲ溶质的主要成分是NiSO4,加Na2CO3过滤后,再加适量稀硫酸溶解又生成NiSO4,这两步操作的目的是增大成NiSO4浓度,有利于蒸发结晶.
分析 (1)铬化合价由+6价降低到+3价,硫由+4价升高到+6价,依据得失电子守恒、原子个数守恒配平方程式;
(2)二氧化锰据有氧化性,加热条件下能够氧化浓盐酸,本身被还原为二价锰离子;
(3)根据从溶液中分离固体的操作:蒸发结晶以及过滤操作需要的仪器进行分析;
(4)①依据沉淀转化规律:难溶的沉淀能够转化为更难溶的沉淀;
②对滤液Ⅱ先加W,应为过氧化氢,可氧化Fe2+生成Fe3+,还原产物为水,不会引人新的杂质,有利于水解生成氢氧化铁沉淀而除去;
③过滤后在滤液中加入碳酸钠,可生成NiCO3,过滤后加入硫酸可生成NiSO4,经蒸发、浓缩、冷却结晶可得到硫酸镍晶体.
解答 解:(1)铬化合价由+6价降低到+3价,硫由+4价升高到+6价,要使得失电子守恒,Cr2O72-系数为1,则SO32-系数3,然年依据原子个数守恒配平方程式:Cr2O72-+3SO32-+8 H+=2Cr3++3SO42-+4H2O;
故答案为:1;3;8 H+;2;3;4;
(2)二氧化锰据有氧化性,加热条件下能够氧化浓盐酸,本身被还原为二价锰离子,离子方程式为MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;
故答案为:将MnO2还原成Mn2+;MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;
(3)将上述固体按固液体积比2:9加入浓盐酸、加热,反应完全后过滤、浓缩,浓缩需要使用酒精灯、三脚架,还需要的仪器有:玻璃棒、蒸发皿;
故答案为:蒸发皿、玻璃棒;
(4)①硫化铜溶解度小于硫化亚铁,向滤液Ⅰ中加入FeS,发生沉淀的转化,离子方程式:FeS(s)+Cu2+(aq)=Fe2+(aq)+CuS(s);
故答案为:FeS(s)+Cu2+(aq)=Fe2+(aq)+CuS(s);
②对滤液Ⅱ先加W,应为过氧化氢,可氧化Fe2+生成Fe3+,还原产物为水,不会引人新的杂质,有利于水解生成氢氧化铁沉淀而除去;
故答案为:H2O2;将Fe2+ 氧化为Fe3+ 除去Fe2+;
③滤液Ⅲ溶质的主要成分是NiSO4,再加入碳酸钠过滤后,加稀硫酸溶解又生成NiSO4,可增大成NiSO4浓度,有利于蒸发结晶;
故答案为:增大成NiSO4浓度,有利于蒸发结晶.
点评 本题为工艺流程题,考查了氧化还原反应方程式、离子方程式的书写,沉淀溶解平衡等,题目综合性较强,难度较大,注意对基础知识的积累.

 名校课堂系列答案
名校课堂系列答案| 选项 | 实验 | 现象 | 结论或解释 |
| A | 向溶液中滴加少量氯水,再滴加KSCN溶液 | 溶液变红 | 证明溶液中含有Fe2+ |
| B | 用铜与稀硫酸检验溶液中的 NO3- | 加热后,试管口有红棕色气体产生 | 硝酸根离子在酸性条件下与铜反应生成NO2 |
| C | 将铝箔放在火焰上灼烧 | 熔化物悬挂不下落 | 铝表面生成高熔点氧化铝未熔化 |
| D | 用盐酸标准液滴定未知浓度的Na2CO3溶液 | 分别用甲基橙和酚酞做指示剂时消耗盐酸的体积相等 | 标准液的用量只与待测液的物质的量有关,与指示剂无关 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 4个 | B. | 3个 | C. | 2个 | D. | 1个 |
| A. | 该实验表明SO2有漂白性 | B. | 白色沉淀为BaSO3 | ||
| C. | 该实验表明FeCl3有还原性 | D. | 反应后溶液酸性增强 |
| A. | 向明矾溶液中滴加Ba(OH)2溶液,恰好使SO42-沉淀完全:2Al3++3SO42-+3Ba2++6OH-═3BaSO4↓+2Al(OH)3↓ | |
| B. | Na2S2O3溶液中加入稀盐酸:2S2O32-+2H+═SO4 2-+S↓+H2O | |
| C. | 10 mL 0.1 mol/L FeI2溶液与标况下0.224L Cl2:Fe2++Cl2=2Cl-+2Fe3+ | |
| D. | 磁性氧化铁溶于稀硝酸:3Fe3O4+28H++NO3-═9Fe3++NO↑+14H2O |
| A. | 在人体内酶的作用下,纤维素可以发生水解生成葡萄糖 | |
| B. | 福尔马林(甲醛溶液)可用于浸泡生肉及海产品以防腐保鲜 | |
| C. | 新型材料聚酯纤维、光导纤维都属于有机高分子材料 | |
| D. | 医药中常用酒精来消毒,是因为酒精能够使病毒的蛋白质发生变性 |
①H2(g)+HCl=HClI(g)+H(g)(慢)
②H(g)+ICl(g)=HCl(g)+I(g)(快)
③HClI(g)=HCl(g)+I(g)(快)
④I(g)+I(g)=I2(g)(快)
下列有关该反应的说法正确的是( )
| A. | 该反应的速率主要①决定 | B. | HClI是该反应的催化剂 | ||
| C. | v(H2)=v(HCl)=v(I2) | D. | a值越小,该反应速率越快 |
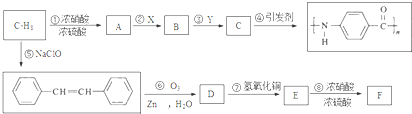
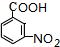 .A~E中互为同分异构体的还有
.A~E中互为同分异构体的还有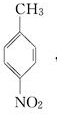 和
和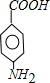 .(填结构简式)
.(填结构简式)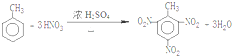 .
.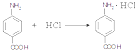 .
.