题目内容
2.已知反应:H2(g)+ICl(g)→HCl(g)+I2(未配平),当生产1molI2时△H=aKJ•mol-1.其反应历程如下:①H2(g)+HCl=HClI(g)+H(g)(慢)
②H(g)+ICl(g)=HCl(g)+I(g)(快)
③HClI(g)=HCl(g)+I(g)(快)
④I(g)+I(g)=I2(g)(快)
下列有关该反应的说法正确的是( )
| A. | 该反应的速率主要①决定 | B. | HClI是该反应的催化剂 | ||
| C. | v(H2)=v(HCl)=v(I2) | D. | a值越小,该反应速率越快 |
分析 A.化学反应的反应速率取决于反应速率最慢的反应;
B.催化剂在最初的反应中参加反应、在最终的反应中生成;
C.同一可逆反应中,反应速率之比等于其计量数之比;
D.反应速率v越小,说明该反应越慢.
解答 解:A.化学反应的反应速率取决于反应速率最慢的反应,所以该反应的速率主要由①决定,故A正确;
B.催化剂在最初的反应中参加反应、在最终的反应中生成,HClI先生成后参加反应,所以不能催化剂,故B错误;
C.同一可逆反应中,反应速率之比等于其计量数之比,该反应方程式为H2(g)+2ICl(g)=2HCl(g)+I2,所以反应速率2v(H2)=v(HCl)=2v(I2),故C错误;
D.反应速率v越小,说明该反应越慢,故D错误.
故选A.
点评 本题考查化学反应机理,侧重考查学生分析判断能力,涉及反应速率快慢判断、决定因素及催化剂等知识点,易错选项是A,题目难度中等.

练习册系列答案
 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案
相关题目
9.关于羟基的说法正确的是( )
| A. | 羟基可以电离成H+和O2- | B. | 1mol羟基共有9mol电子 | ||
| C. | 与氢氧根离子是类别异构 | D. | 羟基只存在于分子晶体中 |
10.下列说法正确的是( )
| A. | 配制1.001.00mol•L-1的NaCl溶液,可将58.5gNaCl溶于1.00L水中 | |
| B. | 在50mL量筒中配制0.100 0moL•L-1碳酸钠溶液 | |
| C. | 只有100mL容量瓶、烧杯、玻璃棒、胶头滴管(非玻璃仪器任选),用pH=1的盐酸无法配制100mLpH=2的盐酸 | |
| D. | 用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏小 |
17.“优先反应思想”是一条重要的化学学科思想.根据所学知识及题目提供的相关数据,回答下列问题:
(1)向FeBr2溶液中滴加少量氯水,溶液变黄.你认为使溶液变黄的微粒其符号是Fe3+,用实验证明你的观点,简述实验操作及现象取适量反应后的溶液滴加KSCN溶液变红.
(2)用惰性电极电解由等物质的量的NaBr、KI、NaCl组成的混合溶液,阳极首先发生的电极反应式是2I--2e-=I2.
(3)已知常温下一些电解质的相关数据如表:
①向等物质的量浓度的Na2CO3、CH3COONa、NaClO组成的混合溶液中逐滴加入稀硫酸,首先发生反应的离子方程式是CO32-+H+=HCO3-.
②向浓度均为0.010mol•L-1的NaCl、Na2CrO4组成的混合溶液中逐滴加入浓度为0.010mol•L-1AgNO3溶液,首先生成的沉淀其化学式为AgCl.
(4)分别向四份各100mL、浓度均为2mol•L-1的FeCl3溶液中,加入铁、铜组成的均匀粉末状混合物,得到如下数据:
①根据表中的数据可求出粉末中铁、铜的物质的量之比为1:1.
②根据表中的数据分析Ⅰ反应后的溶液中存在的金属阳离子有(用离子符号表示)Fe3+、Fe2+、Cu2+.
(1)向FeBr2溶液中滴加少量氯水,溶液变黄.你认为使溶液变黄的微粒其符号是Fe3+,用实验证明你的观点,简述实验操作及现象取适量反应后的溶液滴加KSCN溶液变红.
(2)用惰性电极电解由等物质的量的NaBr、KI、NaCl组成的混合溶液,阳极首先发生的电极反应式是2I--2e-=I2.
(3)已知常温下一些电解质的相关数据如表:
| H2CO3 | Ka1=4.3×10-7 | HClO | Ka=2.95×10-8 |
| Ka2=5.61×10-11 | AgCl | Ksp=1.77×10-10 | |
| CH3COOH | Ka=1.76×10-5 | Ag2CrO4 | Ksp=1.12×10-12 |
②向浓度均为0.010mol•L-1的NaCl、Na2CrO4组成的混合溶液中逐滴加入浓度为0.010mol•L-1AgNO3溶液,首先生成的沉淀其化学式为AgCl.
(4)分别向四份各100mL、浓度均为2mol•L-1的FeCl3溶液中,加入铁、铜组成的均匀粉末状混合物,得到如下数据:
| Ⅰ | Ⅱ | Ⅲ | Ⅳ | |
| FeCl3溶液体积/mL | 100 | 100 | 100 | 100 |
| 加入粉末质量/g | 3 | 6.6 | 9 | 12 |
| 剩余粉末质量/g | 0 | 0.64 | 3.2 | 6.4 |
②根据表中的数据分析Ⅰ反应后的溶液中存在的金属阳离子有(用离子符号表示)Fe3+、Fe2+、Cu2+.
7.下列各项中,表达正确的是( )
| A. | 乙烯的结构简式:C2H4 | B. | F原子结构示意图: | ||
| C. | NH3的结构式: | D. | HCl的电子式: |
11.短周期主族元素X、Y、Z、W的原子序数依次增大,且原子最外层电子数之和为18.X原子半径比Y的小,Z是地壳中含量最高的元素,W与Z同主族.下列说法正确的是( )
| A. | 原子半径由小到大的顺序为:rW<rZ<rY | |
| B. | 简单离子氢化物的热稳定性Z>Y | |
| C. | X2W的沸点高于X2Z | |
| D. | 只含X、Y、W三种元素的化合物,不可能是离子化合物 |
12.下列化学用语使用正确是( )
| A. | 氧原子能量最高的电子的电子云图: | |
| B. | 35Cl与37Cl互为同素异形体 | |
| C. | CH4分子的比例模型: | |
| D. | 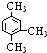 的命名:1,3,4-三甲苯 的命名:1,3,4-三甲苯 |