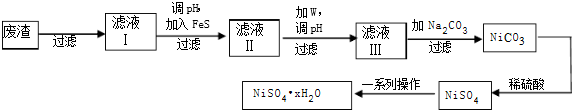
题目内容
13.下列离子方程式正确的是( )| A. | 向明矾溶液中滴加Ba(OH)2溶液,恰好使SO42-沉淀完全:2Al3++3SO42-+3Ba2++6OH-═3BaSO4↓+2Al(OH)3↓ | |
| B. | Na2S2O3溶液中加入稀盐酸:2S2O32-+2H+═SO4 2-+S↓+H2O | |
| C. | 10 mL 0.1 mol/L FeI2溶液与标况下0.224L Cl2:Fe2++Cl2=2Cl-+2Fe3+ | |
| D. | 磁性氧化铁溶于稀硝酸:3Fe3O4+28H++NO3-═9Fe3++NO↑+14H2O |
分析 A.硫酸根离子完全沉淀时,铝离子与氢氧根离子的物质的量之比为1:4,反应产物为偏铝酸钠;
B.Na2S2O3溶液中加入稀盐酸,反应生成氯化钠、二氧化硫、硫和水;
C.碘离子还原性强于二价铁离子,氯气先氧化碘离子;
D.磁性氧化铁溶于稀硝酸反应生成硝酸铁、一氧化氮和水.
解答 解:A.明矾溶液中滴加Ba(OH)2至SO42-完全沉淀,铝离子恰好反应生成偏铝酸根离子,反应的化学方程式为:KAl(SO4)2+2Ba(OH)2=2BaSO4↓+KAlO2+2H2O,对应的离子方程为:Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+AlO2-+2H2O,故A错误;
B.Na2S2O3溶液中加入稀盐酸,离子方程式:2S2O32-+2H+═SO2↑+S↓+H2O,故B错误;
C.10 mL 0.1 mol/L FeI2溶液含碘化亚铁0.001mol,与标况下0.224L Cl2物质的量为0.01mol,氯气足量碘离子二价铁离子都被氧化,离子方程式:4I-+2Fe2++3Cl2=6Cl-+2I2+2Fe3+,故C错误;
D.磁性氧化铁溶于稀硝酸反应生成硝酸铁、一氧化氮和水,离子方程式:3Fe3O4+28H++NO3-═9Fe3++NO↑+14H2O,故D正确.
故选:D.
点评 本题考查了离子方程式的书写,明确离子方程式书写的方法及反应实质是解题关键,注意反应物用量对反应的影响,题目难度中等.

练习册系列答案
 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案
相关题目
4.等温等压下,有质子数相等的CO、N2、C2H2三种气体,下列叙述中正确的是( )
| A. | 体积之比13:13:14 | B. | 密度之比14:14:13 | ||
| C. | 质量之比1:1:1 | D. | 原子数之比1:1:1 |
1. 在实验室中,用如图所示装置(尾气处理装置略去)进行下列实验,将①中液体逐滴滴入到②中.实验结果与预测的现象一致的是( )
在实验室中,用如图所示装置(尾气处理装置略去)进行下列实验,将①中液体逐滴滴入到②中.实验结果与预测的现象一致的是( )
 在实验室中,用如图所示装置(尾气处理装置略去)进行下列实验,将①中液体逐滴滴入到②中.实验结果与预测的现象一致的是( )
在实验室中,用如图所示装置(尾气处理装置略去)进行下列实验,将①中液体逐滴滴入到②中.实验结果与预测的现象一致的是( )| 选项 | ①中的物质 | ②中的物质 | 预测②中的现象 |
| A. | 氢氧化钠 | 明矾溶液 | 开始时即产生白色沉淀 |
| B. | 浓硫酸 | 铜片 | 产生无色气体,溶液变蓝 |
| C. | 浓硝酸 | 用砂纸打磨过的铝条 | 产生红棕色气体 |
| D. | 稀盐酸 | 碳酸钠与氢氧化钠的混合溶液 | 开始时无明显现象 |
| A. | A | B. | B | C. | C | D. | D |
18.某新研制药品的主要成分结构如下所示.关于其说法不正确的是( )
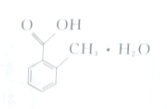

| A. | 其分子为C8H8O2•H2O | |
| B. | 该物质属于水合物 | |
| C. | 1 mol该物质可与3 mol H2发生加成反应 | |
| D. | 该有机物属于芳香烃类 |
2.下列化学反应先后顺序判断正确的是( )
| A. | 在含有等物质的量的H+、Al3+的溶液中,逐滴加入NaOH溶液:H+、Al3+、Al(OH)3 | |
| B. | 在含有等物质的量的FeBr2、FeI2的溶液中,缓慢通入氯气:I-、Br-、Fe2+ | |
| C. | 在含有等物质的量的NaCl、Na2S的溶液中加入AgN03溶液:NaCl、Na2S | |
| D. | 在含有等物质的量的Fe3+、Cu2+的溶液中加入铁粉:Cu2+、Fe3+ |
7.下列各项中,表达正确的是( )
| A. | 乙烯的结构简式:C2H4 | B. | F原子结构示意图: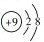 | ||
| C. | NH3的结构式: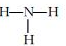 | D. | HCl的电子式: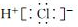 |
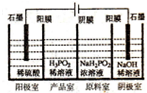 磷单质及其化合物有广泛应用.
磷单质及其化合物有广泛应用.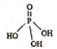 )之间脱去两个水分子的产物,其结构简式为
)之间脱去两个水分子的产物,其结构简式为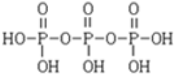 .三聚磷酸钠(俗称“五钠”)是常用的水处理剂,其化学式为Na5P3O10.
.三聚磷酸钠(俗称“五钠”)是常用的水处理剂,其化学式为Na5P3O10.