题目内容
15.足量铜与一定量浓硝酸反应得到硝酸铜溶液和NO2、N2O4、NO 的混合气体,这些气体与2.24LO2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸.若向所得硝酸铜溶液中加入5mol/L NaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是( )| A. | 40mL | B. | 60mL | C. | 80mL | D. | 100mL |
分析 向所得硝酸铜溶液中加入NaOH溶液至Cu2+恰好完全沉淀,沉淀为Cu(OH)2,由电荷守恒可知,Cu提供电子物质的量等于氢氧化铜中氢氧根的物质的量,生成NO2、N2O4、NO 的混合气体与2.24L O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸,纵观整个过程,由电子转移守恒,可知Cu提供电子等于氧气获得的电子,据此计算n(NaOH),进而计算消耗氢氧化钠溶液体积.
解答 解:生成NO2、N2O4、NO的混合气体与2.24L O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸,纵观整个过程,由电子转移守恒,可知Cu提供电子等于氧气获得的电子,即Cu提供电子为:$\frac{2.24L}{22.4L/mol}$×4=0.4mol,
向所得硝酸铜溶液中加入NaOH溶液至Cu2+恰好完全沉淀,沉淀为Cu(OH)2,由电荷守恒可知,Cu提供电子物质的量等于氢氧化铜中氢氧根的物质的量,故n(NaOH)=0.4mol,故消耗氢氧化钠溶液体积为$\frac{0.4mol}{5mol/L}$=0.08L=80mL,
故选C.
点评 本题考查混合物计算,难度中等,侧重考查学生的分析思维能力与解题方法技巧,注意利用守恒法进行解答.

练习册系列答案
相关题目
6.下列各组物质中化学键的类型相同的是( )
| A. | HCl MgCl2 NH4Cl | B. | H2O Na2O CO2 | ||
| C. | CaCl2 NaOH H2S | D. | NH3 H2O CO2 |
3.铝合金在日常生活、航空航天和汽车制造等方面均有广泛用途.下列关于铝的说法不正确的是( )
| A. | 铝的表面容易形成致密的氧化膜,抗腐蚀性能好 | |
| B. | 常温下不与任何碱反应 | |
| C. | 铝元素在地壳中的含量高,储量丰富 | |
| D. | 工业上可以用电解法冶炼铝 |
10.将0.4mol金属Al全部转化为Al(OH)3,消耗a mol HCl、b mol NaOH,则a+b的最小值为( )
| A. | 1.6 | B. | 0.8 | C. | 0.6 | D. | 0.4 |
20.某混合烃由两种气态烃组成,取2.24L(气体体积均在标准状况下测定)该混合气体燃烧后,得3.36LCO2和3.6g水,则关于该混合烃的组成判断正确的是( )
| A. | 一定含甲烷 | B. | 一定有乙烷 | ||
| C. | 一定是甲烷和乙烯的混合气体 | D. | 一定是甲烷和丙炔的混合气体 |
4.在容积为2L的密闭容器中,有反应mA(g)+nB(g)?pC(g)+qD(g),经过5min达到平衡,此时各物质的变化为A减少a mol/L,B的平均反应速率v(B)=$\frac{a}{15}$mol/(L•min),C增加$\frac{2a}{3}$( mol/L),这时若增加系统压强,发现A与C的体积分数不变,则m:n:p:q等于( )
| A. | 3:1:2:2 | B. | 1:3:2:2 | C. | 1:3:2:1 | D. | 1:1:1:1 |
5.下列有机化合物分子中含有手性碳原子,且与H2发生加成反应后仍含有手性碳原子的是( )
| A. | CH3CH2CHO | B. | OHCCH(OH)CH2OH | ||
| C. |  | D. | 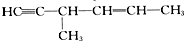 |