题目内容
10.将0.4mol金属Al全部转化为Al(OH)3,消耗a mol HCl、b mol NaOH,则a+b的最小值为( )| A. | 1.6 | B. | 0.8 | C. | 0.6 | D. | 0.4 |
分析 方案①:Al$\stackrel{HCl}{→}$AlCl3$\stackrel{NaOH}{→}$Al(OH)3,发生反应依次:2Al+6HCl=2AlCl3+3H2↑、AlCl3+3NaOH=Al(OH)3↓+3NaCl;
方案②:Al$\stackrel{NaOH}{→}$NaAlO2$\stackrel{HCl}{→}$Al(OH)3,发生反应依次为:2NaOH+2Al+2H2O=2NaAlO2+3H2↑、NaAlO2+HCl+H2O=Al(OH)3↓+3NaCl;
方案③:$\left.\begin{array}{l}{Al\stackrel{HCl}{→}AlC{l}_{3}}\\{Al\stackrel{NaOH}{→}NaAl{O}_{2}}\end{array}\right\}→Al(OH)_{3}$,最后一步发生反应:AlCl3+3NaAlO2+6H2O=4Al(OH)3↓+3NaCl,结合方程式计算各方案需要HCl、NaOH物质的量,进而确定a+b的最小值.
解答 解:方案①:Al$\stackrel{HCl}{→}$AlCl3$\stackrel{NaOH}{→}$Al(OH)3,
2 Al+6 HCl=2AlCl3+3H2↑、AlCl3+3NaOH=Al(OH)3↓+3NaCl
0.4mol 1.2mol 0.4mol 0.4mol 1.2mol
故a+b的最小值为1.2mol+1.2mol=2.4mol;
方案②:Al$\stackrel{NaOH}{→}$NaAlO2$\stackrel{HCl}{→}$Al(OH)3,
2 NaOH+2Al+2H2O=2NaAlO2+3H2↑、NaAlO2+HCl+H2O=Al(OH)3↓+3NaCl;
0.4mol 0.4mol 0.4mol 0.4mol 0.4mol
故a+b的最小值为0.4mol+0.4mol=0.8mol;
方案③:$\left.\begin{array}{l}{Al\stackrel{HCl}{→}AlC{l}_{3}}\\{Al\stackrel{NaOH}{→}NaAl{O}_{2}}\end{array}\right\}→Al(OH)_{3}$,与Al原子守恒可知,Al(OH)3为0.4mol,
AlCl3+3NaAlO2+6H2O=4Al(OH)3↓+3NaCl
0.1mol 0.3mol 0.4mol
2 Al+6 HCl=2AlCl3+3H2↑
0.3mol 0.1mol
2 NaOH+2Al+2H2O=2NaAlO2+3H2↑
0.3mol 0.3mol
故a+b的最小值为0.3mol+0.3mol=0.6mol,
故选C.
点评 本题以氢氧化铝的制备为载体,考查化学方程式计算、实验方案设计等,注意根据节约原料选择最佳方案.

| A. | 向烧碱溶液中滴加少量氯化铝溶液:Al3++4OH-═AlO2-+2H2O | |
| B. | 物质的量相等的溴化亚铁跟氯气反应:2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl- | |
| C. | 硫化钾晶体溶于水:S2-+2H2O?2OH-+H2S | |
| D. | 向碳酸钠溶液中滴加过量的稀硫酸:CO32-+2H+═CO2↑+H2O |
| A. | 放电时负极反应为:Zn-2e-+2OH-=Zn(OH)2 | |
| B. | 放电时每转移3mol电子,正极有1molK2FeO4被氧化 | |
| C. | 充电时阳极反应为:Fe(OH)3-3e-+5OH-=FeO42-+4H2O | |
| D. | 放电时正极附近溶液的碱性增强 |
| A. | 40mL | B. | 60mL | C. | 80mL | D. | 100mL |
| A. | 盐酸、空气、醋酸、干冰 | B. | 铁、海水、硫酸钠、乙醇 | ||
| C. | 硫酸、蔗糖、烧碱、石灰石 | D. | 胆矾、漂白粉、氯化钾、硫酸钡 |
①a、c皆能与稀硫酸反应放出气体;
②b与d的硝酸盐反应,置换出单质d;
③c与强碱反应放出气体;
④c、e在冷浓硫酸中发生钝化.由此可判断a、b、c、d、e依次为( )
| A. | Fe Cu Al Ag Mg | B. | Al Cu Mg Ag Fe | ||
| C. | Mg Cu Al Ag Fe | D. | Mg Ag Al Cu Fe |
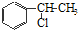 、
、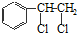 等都是A和Cl2发生反应生成的产物,E是一种发生加聚反应的聚合物物,透光性能好,常用作一些灯饰外壳.过程中一些小分子都已经略去
等都是A和Cl2发生反应生成的产物,E是一种发生加聚反应的聚合物物,透光性能好,常用作一些灯饰外壳.过程中一些小分子都已经略去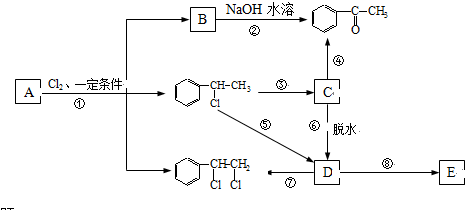
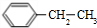 +2Cl2$\stackrel{光照}{→}$
+2Cl2$\stackrel{光照}{→}$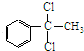 +2HCl,该反应类型为取代反应;
+2HCl,该反应类型为取代反应;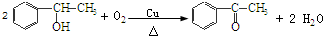 ,该反应类型为氧化反应;
,该反应类型为氧化反应;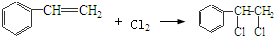 ,该反应类型为加成反应;
,该反应类型为加成反应;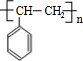 ;
;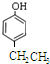 、
、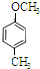 、
、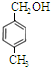 .
.