题目内容
5.下列有机化合物分子中含有手性碳原子,且与H2发生加成反应后仍含有手性碳原子的是( )| A. | CH3CH2CHO | B. | OHCCH(OH)CH2OH | ||
| C. | 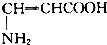 | D. | 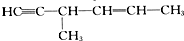 |
分析 手性碳原子指连有四个不同基团的碳原子,手性碳原子判断注意:1、手性碳原子一定是饱和碳原子;2、手性碳原子所连接的四个基团要是不同的.
解答 解:A.CH3CH2CHO能与氢气发生加成反应生成CH3CH2CH2OH,无手性碳原子,故A错误;
B.OHCCH(OH)CH2OH能与氢气发生加成反应生成CH(CH2OH)3,无手性碳原子,故B错误;
C.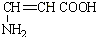 能与氢气发生加成反应生成NH2CH2CH2COOH,无手性碳原子,故C错误;
能与氢气发生加成反应生成NH2CH2CH2COOH,无手性碳原子,故C错误;
D.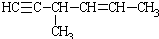 能与氢气发生加成反应生成CH3CH2CH(CH3)CH2CH2CH3,左边起第三个碳原子为手性碳原子,故D正确.
能与氢气发生加成反应生成CH3CH2CH(CH3)CH2CH2CH3,左边起第三个碳原子为手性碳原子,故D正确.
故选D.
点评 本题主要考查了不饱和醇以及醛能与氢气发生加成反应生成饱和醇及手性碳原子的判断等,题目难度不大,抓住官能团的性质是解题的关键.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
15.足量铜与一定量浓硝酸反应得到硝酸铜溶液和NO2、N2O4、NO 的混合气体,这些气体与2.24LO2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸.若向所得硝酸铜溶液中加入5mol/L NaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是( )
| A. | 40mL | B. | 60mL | C. | 80mL | D. | 100mL |
16.下列实验操作中错误的是( )
| A. | 分液时,分液漏斗中下层液体从下口放出,上层液体上口倒出 | |
| B. | 蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口 | |
| C. | 在苯甲酸重结晶实验中,粗苯甲酸加热溶解后还需加少量蒸馏水再趁热过滤 | |
| D. | 除去混在乙酸乙酯中杂质乙酸时,可先加入饱和烧碱溶液振荡后静置,再分液 |
13.实验室中,下列除去括号内杂质的有关操作正确的是( )
| A. | 苯(硝基苯):加少量蒸馏水振荡,待分层后分液 | |
| B. | CO2(HCl、水蒸气):通过盛有碱石灰的干燥管 | |
| C. | 乙烷(乙烯):通入氢气发生加成反应 | |
| D. | 乙醇(水):加新制的生石灰,蒸馏 |
20.a、b、c、d、e分别是Cu、Ag、Fe、Al、Mg五种金属中的一种.已知:
①a、c皆能与稀硫酸反应放出气体;
②b与d的硝酸盐反应,置换出单质d;
③c与强碱反应放出气体;
④c、e在冷浓硫酸中发生钝化.由此可判断a、b、c、d、e依次为( )
①a、c皆能与稀硫酸反应放出气体;
②b与d的硝酸盐反应,置换出单质d;
③c与强碱反应放出气体;
④c、e在冷浓硫酸中发生钝化.由此可判断a、b、c、d、e依次为( )
| A. | Fe Cu Al Ag Mg | B. | Al Cu Mg Ag Fe | ||
| C. | Mg Cu Al Ag Fe | D. | Mg Ag Al Cu Fe |
14.用等量的小苏打制取CO2,可用①煅烧法、②与酸作用,两种方法得到CO2的量哪个多( )
| A. | 无法比较 | B. | 相等 | C. | ①少于② | D. | ①多于② |
15.背景材料:(1)重庆工商及警方查获灌注重晶石粉的活鸡近千只.(2)台湾查获饮料食品违法添加有毒塑化剂一邻苯二甲酸酯(DEHP).(3)铅中毒被视为当今儿童智能发育的“第一杀手”.(4)日本福岛第一核电站造成含131I的放射性物质泄漏.下列有关说法正确是( )
| A. | 重晶石的主要成分是硫酸钡,可溶于胃酸 | |
| B. | 塑化剂和塑料都是高分子化合物 | |
| C. | 82Pb位于周期表第六周期IVA族 | |
| D. | 碘元素的相对原子质量是131 |
 已知A、B、C、D、E五种元素的原子序数依次增大,其中A、E原子的最外层电子数均等于其周期序数,E原子的电子层数是A的3倍;B原子核外电子有6种不同的运动状态,S轨道电子数是P轨道电子数的两倍;D原子L层上有2对成对电子.请回答下列问题:
已知A、B、C、D、E五种元素的原子序数依次增大,其中A、E原子的最外层电子数均等于其周期序数,E原子的电子层数是A的3倍;B原子核外电子有6种不同的运动状态,S轨道电子数是P轨道电子数的两倍;D原子L层上有2对成对电子.请回答下列问题: