题目内容
11.无论是从在国民经济中的地位来看,还是从科学发展的角度来看,硅都发挥着重要的作用.(1)瑞典化学家贝采尼乌斯用金属钾还原SiF4获得单质硅,写出化学方程式4K+SiF4═Si+4KF.
(2)由于制取方法和条件的不同,得到的单质硅形态不同,其性质也不同.
①用铝热法还原氟硅酸钾制得较纯净的晶体硅:4Al+3K2SiF6$\frac{\underline{\;高温\;}}{\;}$3Si+2KAlF4+2K2AlF5,关于该反应的说法正确的是AC(填序号).
A.Al是还原剂 B.氧化产物只有KAlF4
C.每转移6NA电子,得到42g Si D.Al元素在KAlF4和K2AlF5中化合价不同
②用白砂子与镁粉混合在高温条件下得到无定形硅,反应的化学方程式为2Mg+SiO2$\frac{\underline{\;高温\;}}{\;}$Si+2MgO.
(3)在野外,为了迅速得到氢气,用硅粉与干燥的Ca(OH)2和NaOH混合,并加强热,即可迅速得到H2、Na2SiO3、CaO.这种混合物叫做生氢剂.请写出该反应的化学方程式Si+2NaOH+Ca(OH)2=Na2SiO3+CaO+2H2↑.
分析 (1)钾与四氟化硅反应生成硅和氟化钾;
(2)①依据反应4Al+3K2SiF6$\frac{\underline{\;高温\;}}{\;}$3Si+2KAlF4+2K2AlF5,各种元素化合价变化解答;
②镁与二氧化硅反应生成硅和氧化镁,依据原子个数守恒判断产物,写出化学方程式;
(3)依据原子个数守恒写出化学方程式.
解答 解:(1)瑞典化学家贝采尼乌斯用金属钾还原SiF4获得单质硅,反应的化学方程式为:4K+SiF4═Si+4KF,故答案为:4K+SiF4═Si+4KF;
(2)①在反应4Al+3K2SiF6$\frac{\underline{\;高温\;}}{\;}$3Si+2KAlF4+2K2AlF5,铝元素化合价升高,硅元素化合价降低,所以铝做还原剂,K2SiF6做氧化剂,硅为还原产物,KAlF4和2K2AlF5为还原产物,反应3mol铝转移12mol电子,生成84g硅,所以每转移6NA电子,得到42g Si,Al元素在KAlF4和K2AlF5中化合价都是+3价,
故选:AC;
②镁与二氧化硅反应生成硅和氧化镁,方程式为:2Mg+SiO2$\frac{\underline{\;高温\;}}{\;}$Si+2MgO,故答案为:2Mg+SiO2$\frac{\underline{\;高温\;}}{\;}$Si+2MgO;
(3)硅粉与干燥的Ca(OH)2和NaOH混合,并加强热,即可迅速得到H2、Na2SiO3、CaO,依据原子个数守恒,转移电子数守恒可得反应的化学方程式为:Si+2NaOH+Ca(OH)2=Na2SiO3+CaO+2H2↑;
故答案为:Si+2NaOH+Ca(OH)2=Na2SiO3+CaO+2H2↑.
点评 本题考查了硅及其化合物的性质,熟悉硅及其化合物的性质、氧化还原反应的规律是解题关键,注意书写方程式时应遵循原子个数守恒.

 互动英语系列答案
互动英语系列答案| A. | 氧化铝和水 | B. | 三氯化铝和氨水 | ||
| C. | 氧化铝和强碱溶液 | D. | 铝和强碱溶液 |
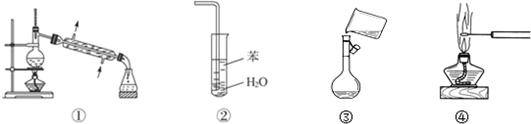
| A. | 装置①常用于分离互不相溶的液体混合物 | |
| B. | 装置②可用于吸收NH3,并防止倒吸 | |
| C. | 图③是将溶解好的溶液转移到容量瓶中 | |
| D. | 图④可观察NaCl的焰色反应 |
| A. | x<n时,钠生成的氢气最多 | B. | x=n时,钠、镁、铝生成的氢气一样多 | ||
| C. | n<x≤2n时,生成的氢气钠<镁=铝 | D. | x≥2n时,生成的氢气钠<镁<铝 |
| A. | 向烧碱溶液中滴加少量氯化铝溶液:Al3++4OH-═AlO2-+2H2O | |
| B. | 物质的量相等的溴化亚铁跟氯气反应:2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl- | |
| C. | 硫化钾晶体溶于水:S2-+2H2O?2OH-+H2S | |
| D. | 向碳酸钠溶液中滴加过量的稀硫酸:CO32-+2H+═CO2↑+H2O |
| A. | sp | B. | sp2 | C. | sp3 | D. | 无法判断 |
| A. | X原子的最外层电子数比Y原子的最外层电子数多 | |
| B. | 原子半径:X>Y | |
| C. | 1mol X从酸中置换出来的氢比1mol Y从酸中置换出来的氢多 | |
| D. | X原子的最高正化合价比Y原子的最高正化合价高 |