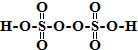题目内容
7.现有浓度均为0.1mol•L-1的五种电解质溶液:①HCl ②NaOH ③CH3COOH ④NH4Cl ⑤NaCl
(1)上述五种溶液的pH由小到大的顺序是①③④⑤②(填序号,下同).
(2)上述五种溶液中,水的电离程度最大的是④.
(3)将上述溶液稀释相同的倍数时,pH不变的是⑤.
分析 浓度均为0.1mol•L-1的五种电解质溶液中,①HCl是强酸,②NaOH是强碱,③CH3COOH是弱酸,④NH4Cl是强酸弱碱盐,水解显酸性,⑤NaCl是强酸强碱盐,溶液显中性,据此分析.
解答 解:(1)HCl是一元强酸,CH3COOH是一元弱酸,NH4Cl是强酸弱碱盐,水解显酸性,但酸性比醋酸弱,NaCl是强酸强碱盐,溶液显中性,NaOH是强碱,所以相同浓度的上述溶液,pH由小到大的顺序为①③④⑤②,故答案为:①③④⑤②;
(2)盐酸、醋酸和氢氧化钠会抑制水的电离,氯化钠对水的电离无影响,NH4Cl是强酸弱碱盐,能够水解,速进水的电离,故答案为:④;
(3)盐酸、醋酸溶液稀释时,其氢离子浓度减小,溶液pH增大,氢氧化钠溶液稀释时,氢氧根离子浓度减小溶液pH减小,氯化铵溶液稀释,溶液酸性减弱,溶液pH增大,氯化钠溶液显中性,加水稀释,pH不变,故答案为:⑤.
点评 本题考查了弱电解质的电离、盐类水解等,难度中等,注意影响水的电离平衡移动的因素与影响弱电解质电离平衡移动的因素相同.

练习册系列答案
相关题目
3.原子轨道的杂化不但出现在分子中,原子团中同样存在原子的杂化.在SO42-中S原子的杂化方式是( )
| A. | sp | B. | sp2 | C. | sp3 | D. | 无法判断 |
15.足量铜与一定量浓硝酸反应得到硝酸铜溶液和NO2、N2O4、NO 的混合气体,这些气体与2.24LO2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸.若向所得硝酸铜溶液中加入5mol/L NaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是( )
| A. | 40mL | B. | 60mL | C. | 80mL | D. | 100mL |
19.按纯净物、混合物、电解质和非电解质顺序排列的一组物质是( )
| A. | 盐酸、空气、醋酸、干冰 | B. | 铁、海水、硫酸钠、乙醇 | ||
| C. | 硫酸、蔗糖、烧碱、石灰石 | D. | 胆矾、漂白粉、氯化钾、硫酸钡 |
16.下列实验操作中错误的是( )
| A. | 分液时,分液漏斗中下层液体从下口放出,上层液体上口倒出 | |
| B. | 蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口 | |
| C. | 在苯甲酸重结晶实验中,粗苯甲酸加热溶解后还需加少量蒸馏水再趁热过滤 | |
| D. | 除去混在乙酸乙酯中杂质乙酸时,可先加入饱和烧碱溶液振荡后静置,再分液 |
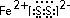 .
.