题目内容
3.A、B、C、D是元素周期表中前四周中五种常见元素,原子序数依次增大.其相关信息如下表:| 元素 | 相关信息 |
| A | 原子核外L层电子数是K层的2倍 |
| C | 有两种同素异形体,其中一种可吸附对人体有害的短波紫外线,防止其到达地球表面 |
| D | 价电子排布为(n+1)s+(n+1)p(n+2) |
| E | 苯酚遇其某种价态的离子显紫色 |
(1)B在元素周期表中位置第二周期VA族;E2+的核外电子排布式是1s22s22p63s23p63d6.
(2)A,B,C的第一电离能由大到小的顺序为N>O>C;A,B,C的氢氧化物稳定性由大到小的顺序为(填写化学式,下同)H2O>NH3>CH4;B,C,D氢化物的沸点最高的为H2O.
(3)1molAD2分子中含有的π键数目为2NA;该化合物的晶体类型是分子晶体.
(4)生活中E单质在NaCl溶液中发生腐蚀时的正极反应式为O2+2H2O+4e-=4OH-.
分析 A、B、C、D是元素周期表中前四周中五种常见元素,原子序数依次增大.A原子核外L层电子数是K层的2倍,L层电子数为4,故A为碳元素;C元素有两种同素异形体,其中一种可吸附对人体有害的短波紫外线,防止其到达地球表面,可推知C为O元素;B元素原子序数介于碳、氧之间,则B为N元素;D元素原子价电子排布为(n+1)sn(n+1)p(n+2),由于s能级最多容纳2个电子,且p能级容纳电子,故s=2,则D为S元素;苯酚遇E元素某种价态的离子显紫色,则E为Fe,据此解答.
解答 解:A、B、C、D是元素周期表中前四周中五种常见元素,原子序数依次增大.A原子核外L层电子数是K层的2倍,L层电子数为4,故A为碳元素;C元素有两种同素异形体,其中一种可吸附对人体有害的短波紫外线,防止其到达地球表面,可推知C为O元素;B元素原子序数介于碳、氧之间,则B为N元素;D元素原子价电子排布为(n+1)sn(n+1)p(n+2),由于s能级最多容纳2个电子,且p能级容纳电子,故s=2,则C为S元素;苯酚遇E元素某种价态的离子显紫色,则E为Fe,
(1)B为N元素,在元素周期表中位置:第二周期VA族;Fe原子失去2个电子形成Fe2+,Fe2+核外电子排布式是:1s22s22p63s23p63d6,
故答案为:第二周期VA族;1s22s22p63s23p63d6;
(2)同周期随原子序数增大,第一电离能呈增大趋势,但N元素2p能级容纳2个电子,为半满稳定状态,能量较低,第一电离能高于同周期相邻元素,故第一电离能:N>O>C;
非金属性O>N>C,故氢化物稳定性:H2O>NH3>CH4;
B,C,D氢化物分别为NH3、H2O、H2S,常温下水为液态,氨气、硫化氢为气体,故H2O的沸点最高,
故答案为:N>O>C;H2O>NH3>CH4;H2O;
(3)CO2分子结构简式为O=C=O,1molCO2分子中含有的π键数目为2NA;该化合物的晶体类型是分子晶体,
故答案为:2NA;分子晶体;
(4)生活中Fe单质在NaCl溶液中发生的腐蚀为吸氧腐蚀,正极是氧气获得电子,中性条件下生成氢氧根离子,正极电极反应式为:O2+2H2O+4e-=4OH-,
故答案为:O2+2H2O+4e-=4OH-.
点评 本题考查结构性质位置关系应用,涉及核外电子排布、元素周期律、物质沸点比较、分子结构与晶体类型、化学腐蚀等,推断元素是解题关键,需要学生熟练掌握基础知识,难度中等.

| A. | Cu$→_{v}^{O_{2}}$CuO$\stackrel{H_{2}SO_{4}}{→}$CuSO4溶液$\stackrel{结晶}{→}$CuSO4•5H2O | |
| B. | Al$→_{v}^{O_{2}}$Al2O3$\stackrel{{H}_{2}S{O}_{4}}{→}$Al2(SO4)3溶液$\stackrel{加热蒸干}{→}$Al2(SO4)3 | |
| C. | FeSO4溶液$\stackrel{{H}_{2}S}{→}$FeS$→_{干燥}^{过滤}$FeS晶体 | |
| D. | MgCl2溶液$→_{过滤}^{NH_{3}}$Mg(OH)2$\stackrel{适量HN{O}_{3}}{→}$Mg(NO3)2溶液$\stackrel{结晶}{→}$Mg(NO3)•6H2O |
| A. | 溴乙烷与NaOH水溶液混合加热后,经冷却,加入硝酸银溶液有淡黄色沉淀 | |
| B. | 淀粉在硫酸作用下水解得到葡萄糖,再加入新制银氨溶液并水浴加热,可得银镜 | |
| C. | 检验溴乙烷消去产物中的乙烯,可将反应逸出的气体直接通入酸性KMnO4溶液中 | |
| D. | 通过核磁共振氢谱的方法,可以检验出溴乙烷在NaOH水溶液中水解的产物有乙醇生成 |
| A. | 饱和NH4Cl溶液中:c(H+)+c(Cl-)=c(NH4+)+2c(NH3•H2O)+c(OH-) | |
| B. | 将AlCl3溶液和Na2SO3溶液分别蒸干并灼烧,得到Al2O3和Na2SO3 | |
| C. | 25℃,若10mLpH=a的盐酸与100mLpH=b 的Ba(OH)2溶液混合恰好中和,则a+b=14 | |
| D. | 25℃,Ka (HF)=3.6×10-4,Ka(CH3COOH)=1.75×10-5,0.1mol/L 的NaF溶液与0.1mol/L 的CH3COOK溶液相比:c(Na+)-c(F-)>c(K+)-c(CH3COO-) |
| A. | 86 | B. | 136 | C. | 50 | D. | 222 |
①
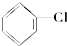 ②
②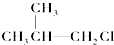 ③(CH3)3C-CH2Cl④CHCl2-CHBr2⑤
③(CH3)3C-CH2Cl④CHCl2-CHBr2⑤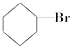 ⑥CH3Cl.
⑥CH3Cl.| A. | ①③⑥ | B. | ②③⑤ | C. | 全部 | D. | ②④ |
| A. | 在AsCl5分子中,各原子最外层都达到了8电子稳定结构 | |
| B. | 砷的相对原子质量为74.92,由此可知砷原子核内有42个中子 | |
| C. | 砷的氢化物的化学式为AsH3,它是一种强氧化剂 | |
| D. | Na3AsO4溶液的pH大于7 |

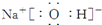 或
或 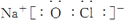 .
.