题目内容
18.下列说法正确的是( )| A. | 饱和NH4Cl溶液中:c(H+)+c(Cl-)=c(NH4+)+2c(NH3•H2O)+c(OH-) | |
| B. | 将AlCl3溶液和Na2SO3溶液分别蒸干并灼烧,得到Al2O3和Na2SO3 | |
| C. | 25℃,若10mLpH=a的盐酸与100mLpH=b 的Ba(OH)2溶液混合恰好中和,则a+b=14 | |
| D. | 25℃,Ka (HF)=3.6×10-4,Ka(CH3COOH)=1.75×10-5,0.1mol/L 的NaF溶液与0.1mol/L 的CH3COOK溶液相比:c(Na+)-c(F-)>c(K+)-c(CH3COO-) |
分析 A.根据氯化铵溶液中的质子守恒和物料守恒分析;
B.亚硫酸钠具有还原性,亚硫酸灼烧后被空气中氧气氧化成硫酸钠;
C.酸碱恰好中和,则盐酸中n(H+)等于氢氧化钡中n(OH-);
D.钠离子和钾离子的浓度相等,酸的电离常数越大,酸性越强,对应的酸根离子的水解程度越小,则溶液中酸根离子浓度越大,据此进行判断.
解答 解:A.饱和NH4Cl溶液中,根据质子守恒可得:c(H+)=c(NH3•H2O)+c(OH-),根据物料守恒可得:c(Cl-)=c(NH4+)+c(NH3•H2O),二者相加可得:c(H+)+c(Cl-)=c(NH4+)+2c(NH3•H2O)+c(OH-),故A正确;
B.氯化铝溶液蒸干灼烧后最终得到的是氧化铝,而亚硫酸钠在灼烧过程中被空气中氧气氧化成硫酸钠,所以最终得到的是硫酸钠,不是亚硫酸钠,故B错误;
C.25℃,若10mLpH=a的盐酸与100mLpH=b 的Ba(OH)2溶液混合恰好中和,则盐酸中n(H+)等于氢氧化钡中n(OH-),所以10-a mol/L×0.01L=1014-bmol/L×0.1L,整理可得:a+b=13,故C错误;
D.25℃,Ka (HF)=3.6×10-4,Ka(CH3COOH)=1.75×10-5,说明醋酸的酸性小于HF,则F-的水解程度小于CH3COO-,溶液中离子浓度大小:c(F-)>cc(CH3COO-),等浓度的两溶液中c(Na+)=c(K+),则c(Na+)-c(F-)<c(K+)-c(CH3COO-),故D错误;
故选A.
点评 本题考查了离子浓度大小比较,题目难度中等,试题涉及酸碱混合的定性判断及pH的计算、盐的水解原理及其应用、离子浓度大小比较等知识,注意掌握电荷守恒、物料守恒、质子守恒及盐的水解原理在判断离子浓度大小中的应用方法.


| A. | 2Ag+(aq)+Cd(s)=2Ag(s)+Cd 2+(aq) | B. | Co2+(aq)+Cd(s)=Co(s)+Cd2+(aq) | ||
| C. | 2Ag(s)+Cd2+(aq)=2Ag+(aq)+Cd(s) | D. | 2Ag+(aq)+Co(s)=2Ag(s)+Co2+(aq) |
| A. | Ba(OH)2溶液与少量的NaHCO3溶液混合:Ba2++2OH-+2HCO3-═BaCO3↓+CO32-+2H2O | |
| B. | 次氯酸钙溶液中通入少量SO2气体:Ca2++2ClO-+SO2+H2O═CaSO3↓+2HClO | |
| C. | 金属钾与水反应:K+H2O═K++OH-+H2↑ | |
| D. | 硫酸氢钠与氢氧化钠溶液的反应:H++OH-═H2O |
| 元素 | 相关信息 |
| A | 原子核外L层电子数是K层的2倍 |
| C | 有两种同素异形体,其中一种可吸附对人体有害的短波紫外线,防止其到达地球表面 |
| D | 价电子排布为(n+1)s+(n+1)p(n+2) |
| E | 苯酚遇其某种价态的离子显紫色 |
(1)B在元素周期表中位置第二周期VA族;E2+的核外电子排布式是1s22s22p63s23p63d6.
(2)A,B,C的第一电离能由大到小的顺序为N>O>C;A,B,C的氢氧化物稳定性由大到小的顺序为(填写化学式,下同)H2O>NH3>CH4;B,C,D氢化物的沸点最高的为H2O.
(3)1molAD2分子中含有的π键数目为2NA;该化合物的晶体类型是分子晶体.
(4)生活中E单质在NaCl溶液中发生腐蚀时的正极反应式为O2+2H2O+4e-=4OH-.
 >H2CO3>
>H2CO3> >HCO3-,现要将
>HCO3-,现要将  转变为
转变为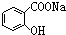 ,可行的方法是( )
,可行的方法是( )| A. | 与足量NaOH溶液共热,再通入足量HCl | |
| B. | 与稀硫酸共热后,加入足量的 NaOH | |
| C. | 与足量NaOH溶液共热,再通入足量的CO2 | |
| D. | 加稀硫酸共热后,再加入足量Na2CO3溶液 |

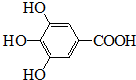 300多年前,著名化学家波义耳发现了铁盐与没食子酸的显色反应,并由此发明了蓝黑墨水.没食子酸的结构式为:
300多年前,著名化学家波义耳发现了铁盐与没食子酸的显色反应,并由此发明了蓝黑墨水.没食子酸的结构式为: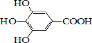 +4NaOH→
+4NaOH→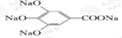 +4H2O.
+4H2O. 据报道,某些花岗岩会产生放射性的氡(${\;}_{86}^{222}$Rn),从而对人体产生伤害.请回答:
据报道,某些花岗岩会产生放射性的氡(${\;}_{86}^{222}$Rn),从而对人体产生伤害.请回答: