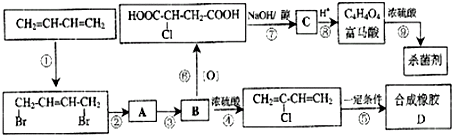
题目内容
12.下列关于砷(As)元素的叙述中,正确的是( )| A. | 在AsCl5分子中,各原子最外层都达到了8电子稳定结构 | |
| B. | 砷的相对原子质量为74.92,由此可知砷原子核内有42个中子 | |
| C. | 砷的氢化物的化学式为AsH3,它是一种强氧化剂 | |
| D. | Na3AsO4溶液的pH大于7 |
分析 A、As最外层有5个电子,AsCl5分子中砷原子成5对共用电子对;
B、砷元素的相对原子质量为74.92是平均计算值,不能确定某一Se原子的质量数;
C、AsH3中As为-3价,它是一种强还原剂;
D、同主族自上而下元素非金属性减弱,同周期自左而右元素非金属性增强,非金属性越强,最高价含氧酸的酸性越强.
解答 解:A、As最外层有5个电子,AsCl5分子中砷原子成5对共用电子对,As外围达到10个电子,故A错误;
B、砷元素的相对原子质量为74.92是平均计算值,不能确定某一Se原子的质量数,不能确定某一As原子的质量数,故B错误;
C、AsH3中As为-3价,为最低价,易失去电子,它是一种强还原剂,故C错误;
D、非金属性S>P>As,非金属性越强,最高价含氧酸的酸性越强,硫酸是强酸,而磷酸为中强酸,砷酸的酸性比磷酸还弱,所以Na3AsO4溶液是强碱弱酸盐,水解导致溶液呈碱性,故D正确;
故选:D.
点评 本题考查原子结构、化学键、元素周期律与元素化合物性质等,题目比较综合,是对基础知识的综合考查,难度中等.

练习册系列答案
相关题目
2.下列说法中不正确的是( )
| A. | 卤族单质,随着相对分子量的增大,分子间作用力增强,熔沸点也相应升高 | |
| B. | 元素周期表有7个主族,7个副族,1个0族,1个Ⅷ族,共16个纵行 | |
| C. | 砹(At)为有色固体,AgAt难溶于水也不溶于稀硝酸 | |
| D. | 在氧气中,铷(Rb)的燃烧产物比钠的燃烧产物更复杂 |
3.A、B、C、D是元素周期表中前四周中五种常见元素,原子序数依次增大.其相关信息如下表:
请回答下列问题:
(1)B在元素周期表中位置第二周期VA族;E2+的核外电子排布式是1s22s22p63s23p63d6.
(2)A,B,C的第一电离能由大到小的顺序为N>O>C;A,B,C的氢氧化物稳定性由大到小的顺序为(填写化学式,下同)H2O>NH3>CH4;B,C,D氢化物的沸点最高的为H2O.
(3)1molAD2分子中含有的π键数目为2NA;该化合物的晶体类型是分子晶体.
(4)生活中E单质在NaCl溶液中发生腐蚀时的正极反应式为O2+2H2O+4e-=4OH-.
| 元素 | 相关信息 |
| A | 原子核外L层电子数是K层的2倍 |
| C | 有两种同素异形体,其中一种可吸附对人体有害的短波紫外线,防止其到达地球表面 |
| D | 价电子排布为(n+1)s+(n+1)p(n+2) |
| E | 苯酚遇其某种价态的离子显紫色 |
(1)B在元素周期表中位置第二周期VA族;E2+的核外电子排布式是1s22s22p63s23p63d6.
(2)A,B,C的第一电离能由大到小的顺序为N>O>C;A,B,C的氢氧化物稳定性由大到小的顺序为(填写化学式,下同)H2O>NH3>CH4;B,C,D氢化物的沸点最高的为H2O.
(3)1molAD2分子中含有的π键数目为2NA;该化合物的晶体类型是分子晶体.
(4)生活中E单质在NaCl溶液中发生腐蚀时的正极反应式为O2+2H2O+4e-=4OH-.
7.已知酸性  >H2CO3>
>H2CO3>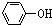 >HCO3-,现要将
>HCO3-,现要将  转变为
转变为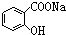 ,可行的方法是( )
,可行的方法是( )
 >H2CO3>
>H2CO3>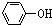 >HCO3-,现要将
>HCO3-,现要将  转变为
转变为 ,可行的方法是( )
,可行的方法是( )| A. | 与足量NaOH溶液共热,再通入足量HCl | |
| B. | 与稀硫酸共热后,加入足量的 NaOH | |
| C. | 与足量NaOH溶液共热,再通入足量的CO2 | |
| D. | 加稀硫酸共热后,再加入足量Na2CO3溶液 |
17.下列说法不正确的是( )
| A. | ⅠA元素的电负性从上到下逐渐减小,ⅦA元素的第一电离能从上到下逐渐减小 | |
| B. | 电负性的大小可以作为衡量元素的金属性和非金属性强弱的尺度 | |
| C. | 氢原子中只有一个电子,故氢原子只有一个原子轨道 | |
| D. | NaH的存在能支持可将氢元素放在ⅦA的观点 |
4.下列各组物质间反应,其中水既不作氧化剂又不作还原剂的氧化还原反应是( )
①F2和H2O ②Na和H2O ③Na2O2和H2O ④P2O5和H2O ⑤Na2O和H2O
⑥Cl2和H2O ⑦NO2和H2O ⑧Al和NaOH溶液.
①F2和H2O ②Na和H2O ③Na2O2和H2O ④P2O5和H2O ⑤Na2O和H2O
⑥Cl2和H2O ⑦NO2和H2O ⑧Al和NaOH溶液.
| A. | ③④⑤⑥⑦ | B. | ①⑤⑦ | C. | ②③⑤⑧ | D. | ③⑥⑦ |
1.某元素X最高价含氧酸的相对分子质量为98,且X的氢化物的分子式不是H2X,则下列说法正确的是( )
| A. | X的最高价含氧酸的分子式可表示为H3XO4 | |
| B. | X是第二周期VA族元素 | |
| C. | X是第三周期ⅥA族元素 | |
| D. | X的最高化合价为+4 |
2.下列说法中正确的是( )
| A. | PCl3分子是三角锥形,这是因为磷原子是sp2杂化的结果 | |
| B. | 乙烯分子中的碳氢键是氢原子的1s轨道和碳原子的一个个sp3杂化轨道形成的 | |
| C. | 中心原子采取sp3杂化的分子,其几何构型可能是四面体形或三角锥形或V形 | |
| D. | AB3型的分子空间构型必为平面三角形 |