题目内容
13.下列选项中最后的物质是要制取的物质,其中不能通过所列变化得到的是( )| A. | Cu$→_{v}^{O_{2}}$CuO$\stackrel{H_{2}SO_{4}}{→}$CuSO4溶液$\stackrel{结晶}{→}$CuSO4•5H2O | |
| B. | Al$→_{v}^{O_{2}}$Al2O3$\stackrel{{H}_{2}S{O}_{4}}{→}$Al2(SO4)3溶液$\stackrel{加热蒸干}{→}$Al2(SO4)3 | |
| C. | FeSO4溶液$\stackrel{{H}_{2}S}{→}$FeS$→_{干燥}^{过滤}$FeS晶体 | |
| D. | MgCl2溶液$→_{过滤}^{NH_{3}}$Mg(OH)2$\stackrel{适量HN{O}_{3}}{→}$Mg(NO3)2溶液$\stackrel{结晶}{→}$Mg(NO3)•6H2O |
分析 A、铜与氧气发生氧化反应生成氧化铜,氧化铜与硫酸反应生成硫酸铜溶液,再结晶得到CuSO4•5H2O晶体;
B、铝与氧气反应生成氧化铝,氧化铝与硫酸反应生成硫酸铝,硫酸为不挥发性酸,所以加热蒸干硫酸铝溶液最终得到硫酸铝晶体;
C、根据硫酸酸性强于硫化氢结合强酸制弱酸判断;
D、氯化镁溶液中通氨气生成氢氧化镁的沉淀,氢氧化镁又溶于硝酸,再结晶得到晶体.
解答 解:A、铜与氧气发生方程式为Cu+O2$\frac{\underline{\;\;△\;\;}}{\;}$CuO,氧化铜与硫酸反应方程式为:CuO+H2SO4=CuSO4+H2O,将所得硫酸铜溶液再结晶可得到CuSO4•5H2O晶体,故A正确;
B、铝与氧气发生方程式为4Al+3O2$\frac{\underline{\;\;△\;\;}}{\;}$2Al2O3,氧化铝与硫酸反应方程式为:Al2O3+3H2SO4=Al2(SO4)3+3H2O,因为硫酸为不挥发性酸,所以加热蒸干硫酸铝溶液得到硫酸铝晶体,故B正确;
C、因为硫酸酸性强于硫化氢,所以硫酸亚铁溶液中通入硫化氢不发生反应,故C错误;
D、氯化镁溶液中通氨气发生方程式为MgCl2+2NH3•H2O=Mg(OH)2↓+2NH4Cl,氢氧化镁与硝酸反应方程式为:Mg(OH)2+2HNO3=Mg(NO3)2+2H2O,将所得溶液再结晶得到Mg(NO3)•6H2O晶体,故D正确.
故选C.
点评 本题目综合考查学生元素以及化合物的性质方面的知识,注意知识的归纳和整理是解题关键,难度不大.

练习册系列答案
 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案
相关题目
1.单晶硅是信息产业中重要的基础材料.通常在高温下还原二氧化硅制得粗硅(含铁、CO等杂质),粗硅与氯气反应生成四氯化硅(反应温度450~500℃)四氯化硅经提纯后用氢气还原可得高纯硅.以下是实验室制备四氯化硅的装置示意图.
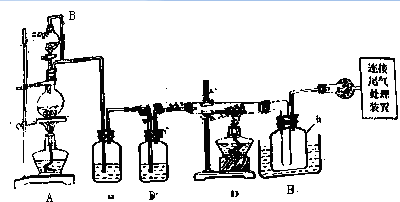
相关信息如下:
a.四氯化硅遇水极易水解;
b.硼、铝、铁、磷在高温下均能与氯气直接反应生成相应的氯化物;
c.有关物质的物理常数见表:
d.已知装置A中发生反应的方程式为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ MnCl2+Cl2↑+2H2O
请回答下列问题:
(1)装置A中g管的作用是平衡压强;装置C中的试剂是浓硫酸;装置E中的h 瓶需要冷却的理由是使SiCl4冷凝收集.
(2)装置E中h瓶收集到的粗产物可通过酒精(类似多次蒸馏)得到高纯度四氯化硅,精馏后的残留物中,除铁元素外可能还含有的杂质元素是Al、P(填写元素符号).

相关信息如下:
a.四氯化硅遇水极易水解;
b.硼、铝、铁、磷在高温下均能与氯气直接反应生成相应的氯化物;
c.有关物质的物理常数见表:
| 物质 | SiCl4 | BCl3 | AlCl3 | FeCl3 | PCl5 |
| 沸点/℃ | 57.7 | 12.8 | | 315 | |
| 熔点/℃ | -70.0 | -107.2 | | | |
| 升华温度/℃ | 180 | 300 | 162 |
请回答下列问题:
(1)装置A中g管的作用是平衡压强;装置C中的试剂是浓硫酸;装置E中的h 瓶需要冷却的理由是使SiCl4冷凝收集.
(2)装置E中h瓶收集到的粗产物可通过酒精(类似多次蒸馏)得到高纯度四氯化硅,精馏后的残留物中,除铁元素外可能还含有的杂质元素是Al、P(填写元素符号).
5.两个体积相同的容器,一个盛有二氧化硫,一个盛有杂质为水蒸气的二氧化碳,在同温(120℃以上)同压(小于1个标准大气压)下,两容器内的气体一定相同的是( )
| A. | 质子总数 | B. | 质量 | C. | 密度 | D. | 原子总数 |
2.下列说法中不正确的是( )
| A. | 卤族单质,随着相对分子量的增大,分子间作用力增强,熔沸点也相应升高 | |
| B. | 元素周期表有7个主族,7个副族,1个0族,1个Ⅷ族,共16个纵行 | |
| C. | 砹(At)为有色固体,AgAt难溶于水也不溶于稀硝酸 | |
| D. | 在氧气中,铷(Rb)的燃烧产物比钠的燃烧产物更复杂 |
3.A、B、C、D是元素周期表中前四周中五种常见元素,原子序数依次增大.其相关信息如下表:
请回答下列问题:
(1)B在元素周期表中位置第二周期VA族;E2+的核外电子排布式是1s22s22p63s23p63d6.
(2)A,B,C的第一电离能由大到小的顺序为N>O>C;A,B,C的氢氧化物稳定性由大到小的顺序为(填写化学式,下同)H2O>NH3>CH4;B,C,D氢化物的沸点最高的为H2O.
(3)1molAD2分子中含有的π键数目为2NA;该化合物的晶体类型是分子晶体.
(4)生活中E单质在NaCl溶液中发生腐蚀时的正极反应式为O2+2H2O+4e-=4OH-.
| 元素 | 相关信息 |
| A | 原子核外L层电子数是K层的2倍 |
| C | 有两种同素异形体,其中一种可吸附对人体有害的短波紫外线,防止其到达地球表面 |
| D | 价电子排布为(n+1)s+(n+1)p(n+2) |
| E | 苯酚遇其某种价态的离子显紫色 |
(1)B在元素周期表中位置第二周期VA族;E2+的核外电子排布式是1s22s22p63s23p63d6.
(2)A,B,C的第一电离能由大到小的顺序为N>O>C;A,B,C的氢氧化物稳定性由大到小的顺序为(填写化学式,下同)H2O>NH3>CH4;B,C,D氢化物的沸点最高的为H2O.
(3)1molAD2分子中含有的π键数目为2NA;该化合物的晶体类型是分子晶体.
(4)生活中E单质在NaCl溶液中发生腐蚀时的正极反应式为O2+2H2O+4e-=4OH-.


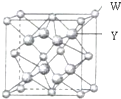 X、Y、Z、W四种元素分别位于周期表中三个紧邻的周期,且原子序数逐渐增大,X和Y的氢化物都比同族下一周期元素氢化物的沸点高,但在同周期中却不是最高的.Z是同周期元素中离子半径最小的元素.W原子的价电子层上有两个运动状态不同的电子.请回答下列问题:
X、Y、Z、W四种元素分别位于周期表中三个紧邻的周期,且原子序数逐渐增大,X和Y的氢化物都比同族下一周期元素氢化物的沸点高,但在同周期中却不是最高的.Z是同周期元素中离子半径最小的元素.W原子的价电子层上有两个运动状态不同的电子.请回答下列问题: