题目内容
11.下面实验方法正确的是( )| A. | 溴乙烷与NaOH水溶液混合加热后,经冷却,加入硝酸银溶液有淡黄色沉淀 | |
| B. | 淀粉在硫酸作用下水解得到葡萄糖,再加入新制银氨溶液并水浴加热,可得银镜 | |
| C. | 检验溴乙烷消去产物中的乙烯,可将反应逸出的气体直接通入酸性KMnO4溶液中 | |
| D. | 通过核磁共振氢谱的方法,可以检验出溴乙烷在NaOH水溶液中水解的产物有乙醇生成 |
分析 A.不能排除AgOH的干扰;
B.银镜反应应在碱性条件下进行;
C.乙醇易挥发,乙醇、乙烯均能被高锰酸钾氧化;
D、乙醇的结构简式为:CH3CH2OH,CH3COOC(CH3)3,该分子的核磁共振氢谱中有3组峰,而溴乙烷是两种峰.
解答 解:A.溴乙烷在碱性条件下水解,如检验是否生成溴离子,应在水解液中加入硝酸酸化,否则不能排除AgOH的干扰,故A错误;
B.银镜反应应在碱性条件下进行,应先加入碱调节溶液至碱性,否则不能生成银镜,故B错误;
C.乙醇易挥发,乙醇、乙烯均能被高锰酸钾氧化,则生成的气体可直接通入到酸性高锰酸钾溶液中,不能检验是否有乙烯生成,故C错误;
D、乙醇的结构简式为:CH3CH2OH,CH3COOC(CH3)3,该分子的核磁共振氢谱中有3组峰,而溴乙烷是两种峰,如果通过核磁共振氢谱检出三种峰说明有乙醇生成,故D正确;
故选D.
点评 本题考查物质的检验和鉴别,把握卤代烃的消去反应及水解产物的检验方法为解答的关键,注意溴乙烷消去产物中的乙烯的检验及选项C为解答的易错点,题目难度不大.

练习册系列答案
 小学教材完全解读系列答案
小学教材完全解读系列答案
相关题目
1.单晶硅是信息产业中重要的基础材料.通常在高温下还原二氧化硅制得粗硅(含铁、CO等杂质),粗硅与氯气反应生成四氯化硅(反应温度450~500℃)四氯化硅经提纯后用氢气还原可得高纯硅.以下是实验室制备四氯化硅的装置示意图.
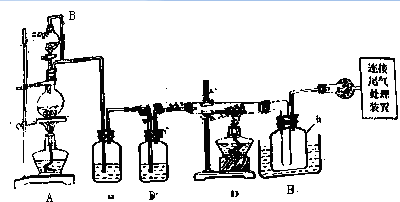
相关信息如下:
a.四氯化硅遇水极易水解;
b.硼、铝、铁、磷在高温下均能与氯气直接反应生成相应的氯化物;
c.有关物质的物理常数见表:
d.已知装置A中发生反应的方程式为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ MnCl2+Cl2↑+2H2O
请回答下列问题:
(1)装置A中g管的作用是平衡压强;装置C中的试剂是浓硫酸;装置E中的h 瓶需要冷却的理由是使SiCl4冷凝收集.
(2)装置E中h瓶收集到的粗产物可通过酒精(类似多次蒸馏)得到高纯度四氯化硅,精馏后的残留物中,除铁元素外可能还含有的杂质元素是Al、P(填写元素符号).

相关信息如下:
a.四氯化硅遇水极易水解;
b.硼、铝、铁、磷在高温下均能与氯气直接反应生成相应的氯化物;
c.有关物质的物理常数见表:
| 物质 | SiCl4 | BCl3 | AlCl3 | FeCl3 | PCl5 |
| 沸点/℃ | 57.7 | 12.8 | | 315 | |
| 熔点/℃ | -70.0 | -107.2 | | | |
| 升华温度/℃ | 180 | 300 | 162 |
请回答下列问题:
(1)装置A中g管的作用是平衡压强;装置C中的试剂是浓硫酸;装置E中的h 瓶需要冷却的理由是使SiCl4冷凝收集.
(2)装置E中h瓶收集到的粗产物可通过酒精(类似多次蒸馏)得到高纯度四氯化硅,精馏后的残留物中,除铁元素外可能还含有的杂质元素是Al、P(填写元素符号).
2.下列说法中不正确的是( )
| A. | 卤族单质,随着相对分子量的增大,分子间作用力增强,熔沸点也相应升高 | |
| B. | 元素周期表有7个主族,7个副族,1个0族,1个Ⅷ族,共16个纵行 | |
| C. | 砹(At)为有色固体,AgAt难溶于水也不溶于稀硝酸 | |
| D. | 在氧气中,铷(Rb)的燃烧产物比钠的燃烧产物更复杂 |
19.已知短周期元素的离子aB+、cC3-、dD-都具有相同的电子层结构.则下列叙述正确的是( )
| A. | 原子半径 B>D>C | |
| B. | 原子序数 d>c>a | |
| C. | 离子半径 C>D>B | |
| D. | 原子结构的最外层电子数目 B>D>C |
6.下列离子方程式书写正确的是( )
| A. | Ba(OH)2溶液与少量的NaHCO3溶液混合:Ba2++2OH-+2HCO3-═BaCO3↓+CO32-+2H2O | |
| B. | 次氯酸钙溶液中通入少量SO2气体:Ca2++2ClO-+SO2+H2O═CaSO3↓+2HClO | |
| C. | 金属钾与水反应:K+H2O═K++OH-+H2↑ | |
| D. | 硫酸氢钠与氢氧化钠溶液的反应:H++OH-═H2O |
3.A、B、C、D是元素周期表中前四周中五种常见元素,原子序数依次增大.其相关信息如下表:
请回答下列问题:
(1)B在元素周期表中位置第二周期VA族;E2+的核外电子排布式是1s22s22p63s23p63d6.
(2)A,B,C的第一电离能由大到小的顺序为N>O>C;A,B,C的氢氧化物稳定性由大到小的顺序为(填写化学式,下同)H2O>NH3>CH4;B,C,D氢化物的沸点最高的为H2O.
(3)1molAD2分子中含有的π键数目为2NA;该化合物的晶体类型是分子晶体.
(4)生活中E单质在NaCl溶液中发生腐蚀时的正极反应式为O2+2H2O+4e-=4OH-.
| 元素 | 相关信息 |
| A | 原子核外L层电子数是K层的2倍 |
| C | 有两种同素异形体,其中一种可吸附对人体有害的短波紫外线,防止其到达地球表面 |
| D | 价电子排布为(n+1)s+(n+1)p(n+2) |
| E | 苯酚遇其某种价态的离子显紫色 |
(1)B在元素周期表中位置第二周期VA族;E2+的核外电子排布式是1s22s22p63s23p63d6.
(2)A,B,C的第一电离能由大到小的顺序为N>O>C;A,B,C的氢氧化物稳定性由大到小的顺序为(填写化学式,下同)H2O>NH3>CH4;B,C,D氢化物的沸点最高的为H2O.
(3)1molAD2分子中含有的π键数目为2NA;该化合物的晶体类型是分子晶体.
(4)生活中E单质在NaCl溶液中发生腐蚀时的正极反应式为O2+2H2O+4e-=4OH-.
1.某元素X最高价含氧酸的相对分子质量为98,且X的氢化物的分子式不是H2X,则下列说法正确的是( )
| A. | X的最高价含氧酸的分子式可表示为H3XO4 | |
| B. | X是第二周期VA族元素 | |
| C. | X是第三周期ⅥA族元素 | |
| D. | X的最高化合价为+4 |
 .
.