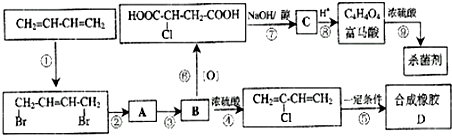
题目内容
15.下列卤代烃在KOH醇溶液中加热不反应的是( )①
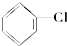 ②
②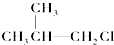 ③(CH3)3C-CH2Cl④CHCl2-CHBr2⑤
③(CH3)3C-CH2Cl④CHCl2-CHBr2⑤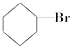 ⑥CH3Cl.
⑥CH3Cl.| A. | ①③⑥ | B. | ②③⑤ | C. | 全部 | D. | ②④ |
分析 卤代烃在KOH醇溶液中加热不反应,则与-Cl(或-Br)相连C的邻位C上没有H,不能发生消去反应,反之可发生消去反应,以此来解答.
解答 解:①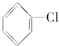 不能发生消去反应,故选;
不能发生消去反应,故选;
②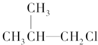 中与-Cl相连C的邻位C上有H,则卤代烃在KOH醇溶液中加热反应,故不选;
中与-Cl相连C的邻位C上有H,则卤代烃在KOH醇溶液中加热反应,故不选;
③(CH3)3C-CH2Cl中,与-Cl相连C的邻位C上没有H,不反应,故选;
④CHCl2-CHBr2 中,与-Cl相连C的邻位C上有H,则卤代烃在KOH醇溶液中加热反应,故不选;
⑤ 中与-Br相连C的邻位C上有H,则卤代烃在KOH醇溶液中加热反应,故不选;
中与-Br相连C的邻位C上有H,则卤代烃在KOH醇溶液中加热反应,故不选;
⑥CH3Cl没有邻位的C,不能发生消去反应,故选;
故选A.
点评 本题考查有机物的结构与性质,为高考常见题型,注意把握官能团与性质的关系,熟悉卤代烃消去反应的结构要求即可解答,题目难度不大.

练习册系列答案
相关题目
5.两个体积相同的容器,一个盛有二氧化硫,一个盛有杂质为水蒸气的二氧化碳,在同温(120℃以上)同压(小于1个标准大气压)下,两容器内的气体一定相同的是( )
| A. | 质子总数 | B. | 质量 | C. | 密度 | D. | 原子总数 |
6.下列离子方程式书写正确的是( )
| A. | Ba(OH)2溶液与少量的NaHCO3溶液混合:Ba2++2OH-+2HCO3-═BaCO3↓+CO32-+2H2O | |
| B. | 次氯酸钙溶液中通入少量SO2气体:Ca2++2ClO-+SO2+H2O═CaSO3↓+2HClO | |
| C. | 金属钾与水反应:K+H2O═K++OH-+H2↑ | |
| D. | 硫酸氢钠与氢氧化钠溶液的反应:H++OH-═H2O |
3.A、B、C、D是元素周期表中前四周中五种常见元素,原子序数依次增大.其相关信息如下表:
请回答下列问题:
(1)B在元素周期表中位置第二周期VA族;E2+的核外电子排布式是1s22s22p63s23p63d6.
(2)A,B,C的第一电离能由大到小的顺序为N>O>C;A,B,C的氢氧化物稳定性由大到小的顺序为(填写化学式,下同)H2O>NH3>CH4;B,C,D氢化物的沸点最高的为H2O.
(3)1molAD2分子中含有的π键数目为2NA;该化合物的晶体类型是分子晶体.
(4)生活中E单质在NaCl溶液中发生腐蚀时的正极反应式为O2+2H2O+4e-=4OH-.
| 元素 | 相关信息 |
| A | 原子核外L层电子数是K层的2倍 |
| C | 有两种同素异形体,其中一种可吸附对人体有害的短波紫外线,防止其到达地球表面 |
| D | 价电子排布为(n+1)s+(n+1)p(n+2) |
| E | 苯酚遇其某种价态的离子显紫色 |
(1)B在元素周期表中位置第二周期VA族;E2+的核外电子排布式是1s22s22p63s23p63d6.
(2)A,B,C的第一电离能由大到小的顺序为N>O>C;A,B,C的氢氧化物稳定性由大到小的顺序为(填写化学式,下同)H2O>NH3>CH4;B,C,D氢化物的沸点最高的为H2O.
(3)1molAD2分子中含有的π键数目为2NA;该化合物的晶体类型是分子晶体.
(4)生活中E单质在NaCl溶液中发生腐蚀时的正极反应式为O2+2H2O+4e-=4OH-.
7.已知酸性  >H2CO3>
>H2CO3> >HCO3-,现要将
>HCO3-,现要将  转变为
转变为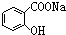 ,可行的方法是( )
,可行的方法是( )
 >H2CO3>
>H2CO3> >HCO3-,现要将
>HCO3-,现要将  转变为
转变为 ,可行的方法是( )
,可行的方法是( )| A. | 与足量NaOH溶液共热,再通入足量HCl | |
| B. | 与稀硫酸共热后,加入足量的 NaOH | |
| C. | 与足量NaOH溶液共热,再通入足量的CO2 | |
| D. | 加稀硫酸共热后,再加入足量Na2CO3溶液 |
4.下列各组物质间反应,其中水既不作氧化剂又不作还原剂的氧化还原反应是( )
①F2和H2O ②Na和H2O ③Na2O2和H2O ④P2O5和H2O ⑤Na2O和H2O
⑥Cl2和H2O ⑦NO2和H2O ⑧Al和NaOH溶液.
①F2和H2O ②Na和H2O ③Na2O2和H2O ④P2O5和H2O ⑤Na2O和H2O
⑥Cl2和H2O ⑦NO2和H2O ⑧Al和NaOH溶液.
| A. | ③④⑤⑥⑦ | B. | ①⑤⑦ | C. | ②③⑤⑧ | D. | ③⑥⑦ |
5.Cl2、漂白液(有效成分为NaClO)在生产、生活中广泛用于杀菌、消毒.
(1)电解NaCl溶液生成Cl2的化学方程式是2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑
(2)①Cl2溶于H2O、NaOH溶液即获得氯水、漂白液.
干燥的氯气不能漂白物质,但氯水却有漂白作用,说明起漂白作用的物质是HClO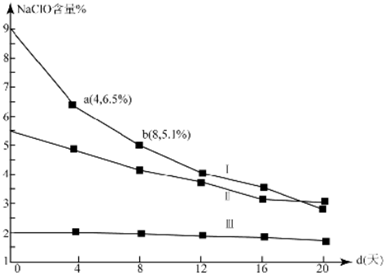
②25℃,Cl2与H2O、NaOH的反应如下:
不直接使用氯水而使用漂白液做消毒剂的原因是K2>K1,反应Ⅱ的有效成分比反应Ⅰ的有效成分大,氯气转化为HClO更充分,次氯酸钠比次氯酸更稳定
(3)家庭使用漂白液时,不宜直接接触铁制品,漂白液腐蚀铁的电极反应为:Fe-2e-=Fe2+:ClO-发生的电极反应式是ClO-+2e-+H2O=Cl-+2OH-
(4)研究漂白液的稳定性对其生产和保存有实际意义.30℃时,pH=11的漂白液中NaClO的质量百分含量随时间变化如下:
①分解速v(Ⅰ)、v(Ⅱ)的大小关系是>,原因是在相同条件下,次氯酸钠的浓度越大,其分解速率越大
②NaClO分解的化学方程式是2NaClO$\frac{\underline{\;30℃\;}}{\;}$2NaCl+O2↑
③4d~8d,Ⅰ中v(NaClO)=0.047mol/(L.d)(常温下漂白液的密度约为1g/cm3,且变化忽略不计)
(1)电解NaCl溶液生成Cl2的化学方程式是2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑
(2)①Cl2溶于H2O、NaOH溶液即获得氯水、漂白液.
干燥的氯气不能漂白物质,但氯水却有漂白作用,说明起漂白作用的物质是HClO

②25℃,Cl2与H2O、NaOH的反应如下:
| 反应Ⅰ | Cl2+H2O?Cl-+H++HClO K1=4.5×10-4 |
| 反应Ⅱ | Cl2+2OH-?Cl-+ClO-+H2O K2=7.5×1015 |
(3)家庭使用漂白液时,不宜直接接触铁制品,漂白液腐蚀铁的电极反应为:Fe-2e-=Fe2+:ClO-发生的电极反应式是ClO-+2e-+H2O=Cl-+2OH-
(4)研究漂白液的稳定性对其生产和保存有实际意义.30℃时,pH=11的漂白液中NaClO的质量百分含量随时间变化如下:
①分解速v(Ⅰ)、v(Ⅱ)的大小关系是>,原因是在相同条件下,次氯酸钠的浓度越大,其分解速率越大
②NaClO分解的化学方程式是2NaClO$\frac{\underline{\;30℃\;}}{\;}$2NaCl+O2↑
③4d~8d,Ⅰ中v(NaClO)=0.047mol/(L.d)(常温下漂白液的密度约为1g/cm3,且变化忽略不计)
 据报道,某些花岗岩会产生放射性的氡(${\;}_{86}^{222}$Rn),从而对人体产生伤害.请回答:
据报道,某些花岗岩会产生放射性的氡(${\;}_{86}^{222}$Rn),从而对人体产生伤害.请回答: