题目内容
4.m g Na在足量Cl2中燃烧,生成的固体质量为(m+3.55)g,则m g Na与O2反应,生成的固体质量可能为( )
①(m+0.8)g ②(m+1.0)g ③(m+1.2)g ④(m+1.4)g ⑤(m+1.6)g.
| A. | ①④ | B. | ① | C. | ④ | D. | 均可以 |
分析 钠在氯气中燃烧生成氯化钠,固体增重质量为氯元素质量,依据Na~Cl计算钠的质量和物质的量钠与氧气反应常温下生成氧化钠,加热生成过氧化钠,利用极值法计算生成固体的质量.
解答 解:mg Na在足量氯气中燃烧,生成NaCl的质量为(m+3.55g),
则m(Cl)=3.55g,
Na~Cl
1 35.5
n 3.55g
$\frac{1}{n}=\frac{35.5}{3.55}$ 解得n=0.1mol;
常温下生成氧化钠,加热生成过氧化钠,钠与氧气反应,全部生成Na2O时,固体质量增重$\frac{0.1mol}{2}$×16g/mol=0.8g;全部生成过氧化钠时,固体质量增加0.1mol×16g/mol=1.6g,
所以钠与氧气反应生成固体的质量:(m+0.8)g≤m(固体)≤(m+1.6)g,
故选:D.
点评 本题考查了有关方程式的计算,熟悉钠的性质是解题关键,注意极值法的应用.

练习册系列答案
 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案
相关题目
14. 短周期元素W、X、Y、Z在元素周期表中的位置如图所示,下列说法正确的( )
短周期元素W、X、Y、Z在元素周期表中的位置如图所示,下列说法正确的( )
 短周期元素W、X、Y、Z在元素周期表中的位置如图所示,下列说法正确的( )
短周期元素W、X、Y、Z在元素周期表中的位置如图所示,下列说法正确的( )| A. | W的非金属元素比Z的弱 | |
| B. | W的最高价氧化物对应的水化物是强酸 | |
| C. | Y的原子半径在同周期主族元素中最大 | |
| D. | Z的气态氢化物的稳定性在同主族元素中最强 |
12.在相同的温度下,100mL 0.01mol/L的醋酸溶液与10mL 0.1mol/L的醋酸溶液相比较,下列数值前者大于后者的是( )
| A. | c(H+) | B. | 醋酸电离的程度 | ||
| C. | 中和时所需 NaOH的量 | D. | 醋酸的物质的量 |
9.下列叙述错误的是( )
| A. | 碱金属元素原子最外层都只有1个电子 | |
| B. | 依Li、Na、K、Rb,单质熔沸点升高,密度增大 | |
| C. | 单质氧化性:F2>Cl2>Br2>I2 | |
| D. | 氢化物稳定性:HF>HCl>HBr>HI |
15.兰州要建成资源节约型和生态保护型省份.下列措施或说法不正确的是( )
| A. | 使用太阳能热水器、沼气利用、玉米制乙醇等都涉及到生物质能的利用 | |
| B. | 用新的无害的汽油添加剂代替四乙基铅抗震剂以减少污染 | |
| C. | 火力发电用煤先进行脱硫处理,积极开发风能、生物质能发电 | |
| D. | 绿色化学要求利用化学原理从源头消除污染,期望在化学反应和化学工业过程中充分利用参与反应的原料,实现零排放 |
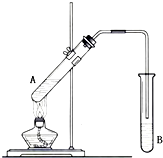 在试管A中加入2mL 乙醇,然后边振荡试管边慢慢加入3mL 浓硫酸和2mL 乙酸,按下图所示连接好装置进行实验,以制取乙酸乙酯.
在试管A中加入2mL 乙醇,然后边振荡试管边慢慢加入3mL 浓硫酸和2mL 乙酸,按下图所示连接好装置进行实验,以制取乙酸乙酯.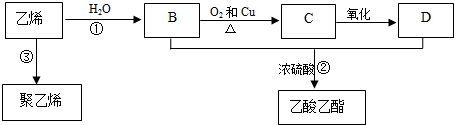
 CH3COOC2H5+H2O.
CH3COOC2H5+H2O. +CaCl2+H2O
+CaCl2+H2O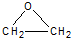
 (用电子式表示).
(用电子式表示).