题目内容
14. 短周期元素W、X、Y、Z在元素周期表中的位置如图所示,下列说法正确的( )
短周期元素W、X、Y、Z在元素周期表中的位置如图所示,下列说法正确的( )| A. | W的非金属元素比Z的弱 | |
| B. | W的最高价氧化物对应的水化物是强酸 | |
| C. | Y的原子半径在同周期主族元素中最大 | |
| D. | Z的气态氢化物的稳定性在同主族元素中最强 |
分析 由元素所在周期表的相对位置可知,X为He,Y为F,W为Cl,则Z为S.
A.同周期自左而右非金属性增强;
B.高氯酸是最强的无机含氧酸;
C.同周期自左而右原子半径减小;
D.元素非金属性越强,对应氢化物越稳定.
解答 解:由元素所在周期表的相对位置可知,X为He,Y为F,W为Cl,则Z为S.
A.同周期元素从左到右元素的非金属性逐渐增强,则非金属性W>Z,故A错误;
B.W为Cl,对应的最高价氧化物对应的水化物HClO4,为最强的含氧酸,故B正确;
C.同周期元素从左到右原子半径逐渐减小,则Y为同周期元素中原子半径最小的,故C错误;
D.同主族元素从上到下元素的非金属性逐渐减弱,元素的非金属性越强,对应的氢化物越稳定,则S元素的氢化物稳定性小于同主族O元素的氢化物稳定性,故D错误.
故选B.
点评 本题考查元素周期表与元素周期律应用,题目难度不大,注意根据元素在周期表中的相对位置判断元素的种类,掌握元素周期律的递变规律.

练习册系列答案
 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案
相关题目
4.工业上用洗净的废铜屑作原料来制备硝酸铜,为了节约原料,宜采取的方法是( )
| A. | Cu+HNO3(浓)→Cu(NO3)2 | |
| B. | Cu+HNO3(稀)→Cu(NO3)2 | |
| C. | Cu$→_{△}^{空气}$Cu$\stackrel{HNO_{3}}{→}$Cu(NO3)2 | |
| D. | Cu $→_{△}^{浓硫酸}$ CuSO4$\stackrel{Ba(NO_{3})_{2}}{→}$Cu(NO3)2 |
2.生活中有不同纯度的水,其中纯度最高的是( )
| A. | 海水 | B. | 雨水 | C. | 蒸馏水 | D. | 自来水 |
9.有关物质检验的实验结论正确的是( )
| A. | 将某气体点燃,产生淡蓝色火焰,该气体一定是H2S | |
| B. | 将某气体通入紫色石蕊中,溶液变红,该气体一定是CO2 | |
| C. | 向某溶液中加入硝酸酸化的氯化钡溶液,生成白色沉淀,溶液中一定含有SO42- | |
| D. | 向某溶液中加入适量浓氢氧化钠溶液共热,产生气体能使湿润红色石蕊试纸变蓝,溶液中一定含有NH4+ |
19.下表列出了①~⑩十种元素在周期表中的位置:
(1)上述①~⑩十种元素中(用元素符号填空):构成有机物的主要元素是C,构成岩石与许多矿物的基本元素是Si,化学性质最不活泼的元素是Ar,气态氢化物的水溶液呈碱性的元素是N.
(2)上述①~⑨元素的最高价氧化物对应的水化物中:碱性最强的物质的化学式为NaOH.
(3)若以元素④和⑤的单质为电极,与元素③的最高价氧化物对应的水化物的水溶液组成原电池,则④的单质在此原电池中作正极(填“正”或“负”)
(4)元素⑦的某氧化物为有刺激性气味的无色气体,其氢化物为有臭鸡蛋气味的无色气体.若这两种气体混合,会生成一种淡黄色粉末.此反应化学方程式为2H2S+SO2=3S↓+2H2O.若此反应中氧化产物的质量为3.2g,则反应中转移的电子数为1.204×1023(填数值).
(5)元素⑧和元素⑨两者核电荷数之差是18,这两种元素中非金属性较弱的元素是溴(填元素名称),能说明这两种元素的非金属性强弱的实验事实是(用离子方程式表示)Cl2+2Br-=2Cl-+Br2.
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑩ | |
| 4 | ⑨ |
(2)上述①~⑨元素的最高价氧化物对应的水化物中:碱性最强的物质的化学式为NaOH.
(3)若以元素④和⑤的单质为电极,与元素③的最高价氧化物对应的水化物的水溶液组成原电池,则④的单质在此原电池中作正极(填“正”或“负”)
(4)元素⑦的某氧化物为有刺激性气味的无色气体,其氢化物为有臭鸡蛋气味的无色气体.若这两种气体混合,会生成一种淡黄色粉末.此反应化学方程式为2H2S+SO2=3S↓+2H2O.若此反应中氧化产物的质量为3.2g,则反应中转移的电子数为1.204×1023(填数值).
(5)元素⑧和元素⑨两者核电荷数之差是18,这两种元素中非金属性较弱的元素是溴(填元素名称),能说明这两种元素的非金属性强弱的实验事实是(用离子方程式表示)Cl2+2Br-=2Cl-+Br2.
6.如图,X、Y、Z、M、N是元素周期表中前四周期中的五种元素,其中M原子的最外层电子数比次外层电子数多4.下列说法不正确的是( )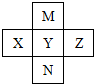
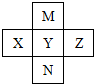
| A. | M形成的氢化物有2种 | |
| B. | M、Y、N的气态氢化物稳定性依次减弱 | |
| C. | X、Y、Z的含氧酸酸性依次增强 | |
| D. | Y的一种氧化物是大气污染物,是形成酸雨的主要物质 |
3.有①Na2CO3溶液 ②NaHCO3溶液 ③NaOH溶液各25mL,物质的量浓度均为0.1mol.L-1,下列说法正确的是( )
| A. | 3种溶液pH的大小顺序是 ③>②>① | |
| B. | 若分别加入25mL0.1mol•L-1盐酸,反应后pH最大的是① | |
| C. | 若将3种溶液稀释相同倍数,pH变化最大的是② | |
| D. | 若3种溶液的pH均为9,则物质的量浓度的大小顺序是③>①>② |