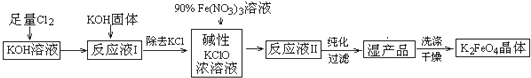
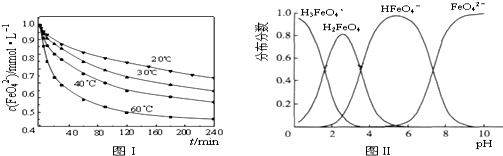
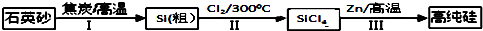题目内容
13.海水中的元素非常丰富,地球上99%的溴元素以Br-的形式存在于海水中,碘存在于海带中,而溴、碘与氯气的性质相似,化学上常把它们放在一起研究.(1)在淀粉碘化钾溶液中滴入少量溴水或通入少量氯气,立即会看到溶液变蓝色.写出溴水与淀粉碘化钾溶液反应的离子方程式2I-+Br2=I2+2Br-
(2)在碘和淀粉形成的蓝色溶液中通入SO2气体,发现蓝色逐渐消失,反应的化学方程式是I2+SO2+2H2O=2HI+H2SO4
(3)从海水晒盐后得到的苦卤中提取溴,可直接通入氯气将溴离子氧化成单质溴,再鼓入热空气或水蒸气将溴从苦卤中分离出来.反应的离子方程式是2Br-+C12=2C1-+Br2
(4)对比(1)、(2)和(3)实验所得的结果,将Cl-、I-、SO2、Br-按还原性由强到弱顺序排列为SO2>I->Br->C1-
(5)KMnO4的氧化性比MnO2强得多,实验室也可以用KMnO4固体和浓盐酸反应制取氯气,反应方程式如下:2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8H2O.
①当有0.3mol e-转移时被氧化的HCl的质量是10.95 g;
②如果将30ml 12mol•L-1的浓盐酸与足量KMnO4充分反应,实际能收集到的氯气在标准状况下的体积将D
A.≥2.52L B.>2.52L C.≤2.52L D.<2.52L.
分析 (1)在淀粉碘化钾溶液中滴入少量溴水,立即会看到溶液变蓝色,说明溴能将碘离子氧化生成碘,碘与淀粉试液变蓝色;
(2)二氧化硫具有还原性,在碘和淀粉形成的蓝色溶液中通入SO2气体,发现蓝色逐渐消失,说明二氧化硫将碘还原生成HI,碘将二氧化硫氧化生成硫酸;
(3)氯气具有强氧化性,能将溴离子氧化生成溴,自身被还原生成氯离子;
(4)在同一氧化还原反应中,还原剂的还原性大于还原产物的还原性;
(5)①根据HCl和转移电子之间的关系式计算;
②浓盐酸和高锰酸钾溶液反应生成氯气,稀盐酸不反应.
解答 (1)在淀粉碘化钾溶液中滴入少量溴水,立即会看到溶液变蓝色,说明溴能将碘离子氧化生成碘,碘与淀粉试液变蓝色,离子方程式为2I-+Br2=I2+2Br-,故答案为:2I-+Br2=I2+2Br-;
(2)二氧化硫具有还原性,在碘和淀粉形成的蓝色溶液中通入SO2气体,发现蓝色逐渐消失,说明二氧化硫将碘还原生成HI,碘将二氧化硫氧化生成硫酸,反应方程式为I2+SO2+2H2O=2 H I+H2SO4,
故答案为:I2+SO2+2H2O=2 H I+H2SO4;
(3)氯气具有强氧化性,能将溴离子氧化生成溴,自身被还原生成氯离子,离子反应方程式为2Br-+C12=2 C1-+Br2,
故答案为:2Br-+C12=2 C1-+Br2;
(4)在同一氧化还原反应中,还原剂的还原性大于还原产物的还原性,(1)中还原性I->Br-,(2)中还原性SO2>I-,(3)中还原性Br->C1-,所以这几种离子还原性大小顺序是SO2>I->Br->C1-,故答案为:SO2>I->Br->C1-;
(5)①根据方程式知,有1mol电子转移时HCl被氧化的物质的量是1mol,则有0.3mol e-转移时被氧化的HCl物质的量是0.3mol,其质量=0.3mol×36.5g/mol=10.95g,
故答案为:10.95;
②n(HCl)=12mol/L×0.03L=0.36mol,根据方程式知,如果浓盐酸完全反应,则0.36mol浓盐酸反应生成V(Cl2)=$\frac{0.36mol×5}{16}$×22.4L/mol=2.52L,浓盐酸和高锰酸钾溶液反应生成氯气,稀盐酸不反应,实际上参加反应的氯化氢物质的量小于0.36mol,所以生成氯气体积小于2.52L,故选D.
点评 本题考查氧化还原反应有关计算、氧化性和还原性强弱比较,为高频考点,明确还原性强弱比较方法及各个物理量之间关系即可解答,注意浓盐酸和高锰酸钾反应但稀盐酸和高锰酸钾溶液不反应,为易错点.

 单元期中期末卷系列答案
单元期中期末卷系列答案| A. | 3种溶液pH的大小顺序是 ③>②>① | |
| B. | 若分别加入25mL0.1mol•L-1盐酸,反应后pH最大的是① | |
| C. | 若将3种溶液稀释相同倍数,pH变化最大的是② | |
| D. | 若3种溶液的pH均为9,则物质的量浓度的大小顺序是③>①>② |
( )
①(m+0.8)g ②(m+1.0)g ③(m+1.2)g ④(m+1.4)g ⑤(m+1.6)g.
| A. | ①④ | B. | ① | C. | ④ | D. | 均可以 |
下列说法中不正确的是( )
| A. | B也可在O2作用下直接转化为D | |
| B. | 当X是强酸时,A可能是Na2S,F是H2SO4 | |
| C. | 当X是强碱时,过量的B与Cl2发生的反应为:3Cl2+2NH3═N2+6HCl | |
| D. | 无论X是强酸还是强碱,在一定条件下,B和D都能相互反应生成C单质 |
| A. | 3υ正(N2)=υ正(H2) | B. | υ正(N2)=υ逆(NH3) | C. | υ正(N2)=3υ逆(H2) | D. | 2υ正(H2)=3υ逆(NH3) |
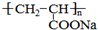 )是一种强吸水树脂.由某烃A合成聚丙烯酸钠的流程如图:
)是一种强吸水树脂.由某烃A合成聚丙烯酸钠的流程如图: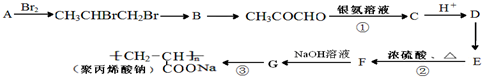
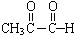 +2Ag(NH3)2OH$\stackrel{△}{→}$
+2Ag(NH3)2OH$\stackrel{△}{→}$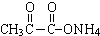 +3NH3+2Ag↓+H2O.
+3NH3+2Ag↓+H2O.