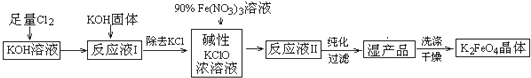
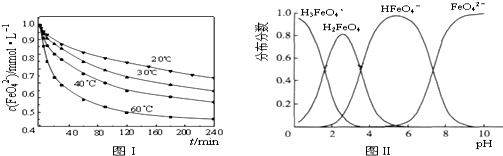
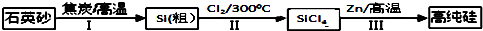题目内容
12.在相同的温度下,100mL 0.01mol/L的醋酸溶液与10mL 0.1mol/L的醋酸溶液相比较,下列数值前者大于后者的是( )| A. | c(H+) | B. | 醋酸电离的程度 | ||
| C. | 中和时所需 NaOH的量 | D. | 醋酸的物质的量 |
分析 醋酸为弱电解质,醋酸的浓度越大,则电离程度越小,但是溶液中氢离子浓度越大;中和时消耗的强氧化钠的物质的量取决于醋酸的物质的量,据此进行判断.
解答 解:A.酸的浓度越大,c(H+)越大,前者小于后者,故A错误;
B.醋酸为弱电解质,溶液浓度越大,电离程度越小,电离程度前者大于后者,故B正确;
C.计算两溶液中醋酸的物质的量,n(前)=c1•V1=0.1 L×0.01 mol•L-1=1×10-3 mol,n(后)=c2•V2=0.01 L×0.1 mol•L-1=1×10-3 mol,两者相等,因而中和时消耗的NaOH的量相等,故C错误;
D.由n=cV可知,100mL 0.01mol/L的醋酸溶液中溶质的物质的量为0.001mol,10mL0.1mol/L的醋酸溶液中溶质的物质的量为0.001mol,但前者浓度小,电离程度大,前者的CH3COOH的物质的量小,故D错误;
故选B.
点评 本题考查弱电解质的电离平衡及其影响,题目难度不大,注意把握弱电解质的电离特点,明确醋酸浓度越大、电离程度越小,但是溶液中氢离子浓度越大,为易错点.

练习册系列答案
相关题目
2.生活中有不同纯度的水,其中纯度最高的是( )
| A. | 海水 | B. | 雨水 | C. | 蒸馏水 | D. | 自来水 |
3.有①Na2CO3溶液 ②NaHCO3溶液 ③NaOH溶液各25mL,物质的量浓度均为0.1mol.L-1,下列说法正确的是( )
| A. | 3种溶液pH的大小顺序是 ③>②>① | |
| B. | 若分别加入25mL0.1mol•L-1盐酸,反应后pH最大的是① | |
| C. | 若将3种溶液稀释相同倍数,pH变化最大的是② | |
| D. | 若3种溶液的pH均为9,则物质的量浓度的大小顺序是③>①>② |
20.在1100℃,一定容积的密闭容器中发生反应:FeO(s)+CO(g)?Fe(s)+CO2(g)△H=a kJ/mol(a>0),该温度下K=0.263,下列有关该反应的说法正确的是( )
| A. | 若生成1 mol Fe,则吸收的热量小于a kJ | |
| B. | 若容器内压强不随时间变化,则可以判断该反应已达到化学平衡状态 | |
| C. | 若升高温度,正反应速率加快,逆反应速率减慢,则化学平衡正向移动 | |
| D. | 达到化学平衡状态时,若c(CO)=0.100 mol/L,则c(CO2)=0.0263 mol/L |
17.下列表示物质结构的化学用语正确的是( )
| A. | 8个中子的碳原子的核素符号:14C | B. | HF的电子式: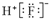 | ||
| C. | Cl-离子的结构示意图: | D. | 氧化铝的化学式:AlO |
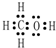 ,Y的中心原子杂化方式为SP2.
,Y的中心原子杂化方式为SP2.