题目内容
15.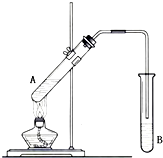 在试管A中加入2mL 乙醇,然后边振荡试管边慢慢加入3mL 浓硫酸和2mL 乙酸,按下图所示连接好装置进行实验,以制取乙酸乙酯.
在试管A中加入2mL 乙醇,然后边振荡试管边慢慢加入3mL 浓硫酸和2mL 乙酸,按下图所示连接好装置进行实验,以制取乙酸乙酯.(1)为防止试管A中的液体在实验时发生暴沸,在加热前应采取的措施是向试管中加入碎瓷片(或沸石).
(2)试管B中盛放的试剂是饱和Na2CO3溶液;反应结束后,若分离B中的液体混合物需要用到的玻璃仪器主要是分液漏斗(可加烧杯).
(3)试管B中盛放的试剂不能(填“能”或“不能”)换成NaOH溶液,原因为CH3COOC2H5+NaOH→CH3COONa+CH3CH2OH(用化学方程式表示).
(4)该实验中不考虑原料挥发和副反应,若用3mol乙醇和1mol乙酸在浓硫酸作用下加热,充分反应后,能否生成1mol乙酸乙酯?不能(填“能”或“不能”),原因是酯化反应为可逆反应,不能进行到底;用30g乙酸与46g乙醇反应,如果实际产量是理论产量的60%,则实际得到的乙酸乙酯的质量是26.4 g.
分析 (1)乙酸乙醇沸点低,液体加热要加碎瓷片,防止暴沸;
(2)用饱和碳酸钠溶液吸收乙酸乙酯,乙醇溶解,碳酸钠与乙酸反应除去乙酸、同时降低乙酸乙酯的溶解度;分离互不相溶的液体通常用分液的方法;
(3)乙酸乙酯在氢氧化钠溶液中能完全水解;
(4)酯化反应属于可逆反应,在该实验中,若用1mol乙醇和1mol乙酸在浓硫酸作用下加热充分反应,若不考虑反应物的挥发,不能生成1mol乙酸乙酯,先判断两种反应物谁过量,按不足量来计算.
解答 解:(1)乙酸、乙醇沸点低,液体加热要加碎瓷片,引入汽化中心,可防止溶液暴沸,
故答案为:向试管中加入碎瓷片(或沸石);
(2)乙醇与乙酸都易挥发,制备的乙酸乙酯含有乙醇与乙酸,通常用饱和碳酸钠溶液吸收乙酸乙酯,中和挥发出来的乙酸,使之转化为乙酸钠溶于水中,溶解挥发出来的乙醇,降低乙酸乙酯在水中的溶解度,便于分层得到酯,因B中的液体混合物分层不互溶,乙酸乙酯在上层,可用分液方法分离,需要用到的玻璃仪器主要是分液漏斗(可加烧杯),
故答案为:饱和Na2CO3溶液;分液漏斗(可加烧杯);
(3)乙酸能与稀NaOH溶液反应,但乙酸乙酯也能在稀NaOH溶液中完全水解,CH3COOC2H5+NaOH→CH3COONa+CH3CH2OH,不符合除杂原则,
故答案为:不能;CH3COOC2H5+NaOH→CH3COONa+CH3CH2OH;
(4)酯化反应属于可逆反应,用1mol乙醇和1mol乙酸在浓硫酸作用下加热充分反应,反应不能完全,则反应生成的乙酸乙酯的物质的量小于1mol,
30g乙酸的物质的量为:30g÷60g/mol═0.5mol,46g乙醇的物质的量为:46g÷46g/mol═1mol,
根据方程式:CH3COOH+HOCH2CH3 CH3COOCH2CH3+H2O
CH3COOCH2CH3+H2O
应按乙酸完全反应来计算理论产生乙酸乙酯的量为0.5mol,质量为0.5mol×88g/mol=44g,实际产量为0.44g×60%=26.4g,
故答案为:不能;酯化反应为可逆反应,不能进行到底;26.4 g.
点评 本题考查乙酸乙酯的制备、有关化学方程式的简单计算,题目难度中等,注意实验的基本操作以及饱和碳酸钠溶液的作用,根据化学方程式的计算是易错点.

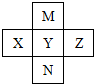
| A. | M形成的氢化物有2种 | |
| B. | M、Y、N的气态氢化物稳定性依次减弱 | |
| C. | X、Y、Z的含氧酸酸性依次增强 | |
| D. | Y的一种氧化物是大气污染物,是形成酸雨的主要物质 |
| A. | 3种溶液pH的大小顺序是 ③>②>① | |
| B. | 若分别加入25mL0.1mol•L-1盐酸,反应后pH最大的是① | |
| C. | 若将3种溶液稀释相同倍数,pH变化最大的是② | |
| D. | 若3种溶液的pH均为9,则物质的量浓度的大小顺序是③>①>② |
| A. | 离子化合物中可能含有共价键 | |
| B. | 在共价化合物中一定含有共价键 | |
| C. | 含离子键的化合物一定是离子化合物 | |
| D. | 含有共价键的化合物一定是共价化合物 |
| A. | 若生成1 mol Fe,则吸收的热量小于a kJ | |
| B. | 若容器内压强不随时间变化,则可以判断该反应已达到化学平衡状态 | |
| C. | 若升高温度,正反应速率加快,逆反应速率减慢,则化学平衡正向移动 | |
| D. | 达到化学平衡状态时,若c(CO)=0.100 mol/L,则c(CO2)=0.0263 mol/L |
( )
①(m+0.8)g ②(m+1.0)g ③(m+1.2)g ④(m+1.4)g ⑤(m+1.6)g.
| A. | ①④ | B. | ① | C. | ④ | D. | 均可以 |
| A. | 3υ正(N2)=υ正(H2) | B. | υ正(N2)=υ逆(NH3) | C. | υ正(N2)=3υ逆(H2) | D. | 2υ正(H2)=3υ逆(NH3) |
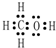 ,Y的中心原子杂化方式为SP2.
,Y的中心原子杂化方式为SP2.