题目内容
19.乙烯是重要化工原料,其产量是一个国家石油化工水平的标志.通过石油裂解可以获得乙烯,再以乙烯为原料还可以合成很多的化工产品.已知乙烯能发生以下转化: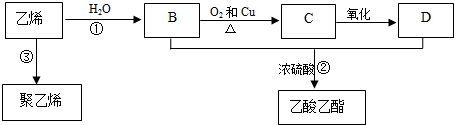
(1)乙酸乙酯的分子式为C4H8O2;乙烯的结构简式为CH2=CH2.
(2)反应①的反应类型是加成反应,D物质的官能团名称为羧基.
(3)写出以下反应的化学方程式:①CH2=CH2+H2O$\stackrel{催化剂}{→}$CH3CH2OH;②C2H5OH+CH3COOH
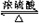 CH3COOC2H5+H2O.
CH3COOC2H5+H2O.(4)乙烯大量用来生产环氧乙烷,生产工艺主要有两种:
工艺一:
CH2═CH2+Cl2+Ca(OH)2→
 +CaCl2+H2O
+CaCl2+H2O工艺二:
2CH2═CH2+O2$\stackrel{Ag}{→}$2
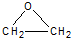
根据绿色化学的原则,理想的生产工艺是原子经济性好的反应,在实际生产中,应采用工艺二(填“工艺一”或“工艺二”)更环保、更经济.
分析 乙烯和水发生加成反应生成B,B为CH3CH2OH,B被催化氧化生成C,C为CH3CHO,C被氧化生成D,D为CH3COOH,B、D发生酯化反应生成乙酸乙酯,乙烯发生加聚反应生成聚乙烯,再结合题目分析解答.
解答 解:乙烯和水发生加成反应生成B,B为CH3CH2OH,B被催化氧化生成C,C为CH3CHO,C被氧化生成D,D为CH3COOH,B、D发生酯化反应生成乙酸乙酯,乙烯发生加聚反应生成聚乙烯,
(1)乙酸乙酯分子式为C4H8O2,乙烯结构简式为CH2=CH2,故答案为:C4H8O2;CH2=CH2;
(2)反应①为乙烯和水的加成反应,D为CH3COOH,含有的官能团为羧基,
故答案为:加成反应; 羧基;
(3)反应①为乙烯和水加成反应生成乙醇,反应的方程式为CH2=CH2+H2O$\stackrel{催化剂}{→}$CH3CH2OH,反应②为乙醇和乙酸发生酯化反应生成乙酸乙酯,反应的方程式为C2H5OH+CH3COOH 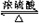 CH3COOC2H5+H2O,
CH3COOC2H5+H2O,
故答案为:CH2=CH2+H2O$\stackrel{催化剂}{→}$CH3CH2OH;C2H5OH+CH3COOH 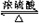 CH3COOC2H5+H2O;
CH3COOC2H5+H2O;
(4)根据绿色化学的原则,理想的生产工艺是原子利用率为100%,无污染,所以在实际生产中,应采用工艺二更环保、更经济,
故答案为:工艺二;
点评 本题考查有机物推断,涉及烯烃、醇、醛、羧酸、酯之间的转化,明确官能团及其性质关系即可解答,注意反应条件,题目难度不大.

练习册系列答案
相关题目
9.有关物质检验的实验结论正确的是( )
| A. | 将某气体点燃,产生淡蓝色火焰,该气体一定是H2S | |
| B. | 将某气体通入紫色石蕊中,溶液变红,该气体一定是CO2 | |
| C. | 向某溶液中加入硝酸酸化的氯化钡溶液,生成白色沉淀,溶液中一定含有SO42- | |
| D. | 向某溶液中加入适量浓氢氧化钠溶液共热,产生气体能使湿润红色石蕊试纸变蓝,溶液中一定含有NH4+ |
10.下列说法中不正确的是( )
| A. | 离子化合物中可能含有共价键 | |
| B. | 在共价化合物中一定含有共价键 | |
| C. | 含离子键的化合物一定是离子化合物 | |
| D. | 含有共价键的化合物一定是共价化合物 |
14.下列说法正确的是( )
| A. | 任何一个氧化还原反应都可以设计为原电池,输出电能 | |
| B. | 常温下,将pH=2的盐酸和pH=12的氨水等体积混合后溶液呈碱性:c(NH4+)>c(Cl-)>c(OH-)>c(H+) | |
| C. | 任何可逆反应,其平衡常数越大,反应速率、反应物的转化率越大 | |
| D. | pH=9的CH3COONa溶液和pH=9的NH3•H2O溶液,两溶液中水的电离程度相同 |
4.m g Na在足量Cl2中燃烧,生成的固体质量为(m+3.55)g,则m g Na与O2反应,生成的固体质量可能为
( )
①(m+0.8)g ②(m+1.0)g ③(m+1.2)g ④(m+1.4)g ⑤(m+1.6)g.
( )
①(m+0.8)g ②(m+1.0)g ③(m+1.2)g ④(m+1.4)g ⑤(m+1.6)g.
| A. | ①④ | B. | ① | C. | ④ | D. | 均可以 |
11.已知断裂1molC-H键,要吸收热量414.4kJ;断裂1mol C-C键,要吸收热量347.4kJ;生成1mol C═C键,会放出热量615.3kJ;生成1mol H-H键,会放出热量435.3kJ,某有机物分解的反应可表示为:
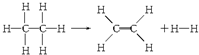
若在反应中消耗了1mol乙烷(反应物),则有关该反应的说法正确的是( )

若在反应中消耗了1mol乙烷(反应物),则有关该反应的说法正确的是( )
| A. | 该反应放出251.2 kJ的热量 | B. | 该反应吸收251.2 kJ的热量 | ||
| C. | 该反应放出125.6 kJ的热量 | D. | 该反应吸收125.6 kJ的热量 |
8.下列关系图中,A是一种正盐,B是气态氢化物,C是单质,F是强酸.当X无论是强酸还是强碱时都有如下转化关系(其他反应产物及反应所需条件均已略去),当X是强碱时,过量的B跟Cl2反应除生成C外,另一产物是盐酸盐.A$\stackrel{X}{→}$B$\stackrel{Cl_{2}}{→}$C$\stackrel{O_{2}}{→}$D$\stackrel{O_{2}}{→}$E$\stackrel{H_{2}O}{→}$F.
下列说法中不正确的是( )
下列说法中不正确的是( )
| A. | B也可在O2作用下直接转化为D | |
| B. | 当X是强酸时,A可能是Na2S,F是H2SO4 | |
| C. | 当X是强碱时,过量的B与Cl2发生的反应为:3Cl2+2NH3═N2+6HCl | |
| D. | 无论X是强酸还是强碱,在一定条件下,B和D都能相互反应生成C单质 |
10.(1)CH3-CH3→CH2=CH2+H2,有关化学键的键能如下:
写出该反应的热化学方程式CH3-CH3(g)→CH2=CH2(g)+H2(g)△H=+125.6 kJ•mol-1
(2)已知下列两个热化学方程式:
2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ•mol-1
C3H8(g)+5O2(g)═3CO2(g)+4H2O(l)△H=-2220kJ•mol-1
根据上面两个热化学方程式,试回答下列问题:
H2的燃烧热为285.8kJ/mol,1mol H2和2mol C3H8组成的混合气体完全燃烧释放的热量为4725.8kJ.
(3)火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水.当它们混合反应时,即产生大量氮气和水蒸气,并放出大量的热.已知0.4mol液态肼与足量的液态双氧水反应,生成氮气和水蒸气,放出256kJ 的热量.写出该反应的热化学方程式N2H4(l)+2 H2O2(l)=N2(g)+4 H2O(g)△H=-640kJ/mol,此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是生成N2和H2O,对环境无污染.
| 化学键 | C-H | C=C | C-C | H-H |
| 键能(kJ/mol) | 414.4 | 615.3 | 347.4 | 435.3 |
(2)已知下列两个热化学方程式:
2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ•mol-1
C3H8(g)+5O2(g)═3CO2(g)+4H2O(l)△H=-2220kJ•mol-1
根据上面两个热化学方程式,试回答下列问题:
H2的燃烧热为285.8kJ/mol,1mol H2和2mol C3H8组成的混合气体完全燃烧释放的热量为4725.8kJ.
(3)火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水.当它们混合反应时,即产生大量氮气和水蒸气,并放出大量的热.已知0.4mol液态肼与足量的液态双氧水反应,生成氮气和水蒸气,放出256kJ 的热量.写出该反应的热化学方程式N2H4(l)+2 H2O2(l)=N2(g)+4 H2O(g)△H=-640kJ/mol,此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是生成N2和H2O,对环境无污染.
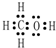 ,Y的中心原子杂化方式为SP2.
,Y的中心原子杂化方式为SP2.