题目内容
13.某试液中只可能含有K+、NH4+、Fe2+、Al3+、Cl-、SO42-、CO32-、AlO2- 中的若干种离子,离子浓度均为0.1mol•L-1,某同学进行了如下实验: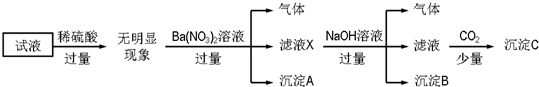
下列说法不正确的是( )
| A. | 沉淀A是BaSO4,说明原试液中一定含有SO42- | |
| B. | 滤液X中大量存在的阳离子有NH4+、Fe3+和Ba2+ | |
| C. | 沉淀C只有一种成分 | |
| D. | 原溶液中一定大量存在的离子只有:NH4+、Fe2+、Cl-、SO42- |
分析 加入过量稀硫酸无明显变化,说明无CO32-、Ba2+和AlO2-;
加入硝酸钡有气体,说明有亚铁离子存在且被氧化,沉淀为硫酸钡;
加入NaOH有气体,说明存在铵根离子,气体氨气,沉淀B为红褐色氢氧化铁沉淀;
通入少量CO2产生沉淀,先与OH-、Ba2+反应,沉淀C为碳酸钡,不能说明存在Al3+.
因为存在的离子浓度均为0.1mol•L-1,从电荷的角度出发,只能含有NH4+、Fe2+、Cl-、SO42-才能保证电荷守恒,K+必然不能存在.
解答 解:加入过量稀硫酸无明显变化,说明无碳酸根离子,无Ba2+,无AlO2-;
加入硝酸钡有气体,因为前面已经加入了硫酸,硝酸根离子在酸性条件下具有强氧化性,说明有亚铁离子存在且被氧化,沉淀为硫酸钡;
加入NaOH有气体,说明存在铵根离子,气体氨气,沉淀B为红褐色氢氧化铁沉淀;
通入少量CO2产生沉淀,先与OH-、Ba2+反应,沉淀C为碳酸钡,不能说明存在Al3+.
因为存在的离子浓度均为0.1mol•L-1,从电荷的角度出发,只能含有NH4+、Fe2+、Cl-、SO42-才能保证电荷守恒,K+必然不能存在.
A、依据分析可知,生成硫酸钡沉淀可能是由于引入硫酸造成的,故A错误;
B、依据分析可知:滤液X中大量存在的阳离子有NH4+、Fe3+和Ba2+,故B正确;
C、沉淀C为碳酸钡,只有一种成分,故C正确;
D、原溶液中一定存在NH4+、Fe2+、Cl-、SO42-,故D正确.故选:A.
点评 本题考查了常见离子的性质检验,注意硝酸根离子在酸性条件下具有强氧化性,另外本题需要根据电荷守恒判断氯离子是否存在,难度较大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
3.下列说法正确的是( )
| A. | 配制FeCl3溶液时,可加入少量的稀硫酸以抑制Fe3+的水解 | |
| B. | MgCl2溶液中混有少量FeCl3杂质,可向混合溶液中加入MgO以除杂 | |
| C. | 氯化铝溶液蒸干灼烧得到的固体物质还是氯化铝 | |
| D. | 无色透明溶液中,Na+、Al3+、SO42-、Cl-、ClO-、I-能大量共存 |
4.下列对各平衡体系的建立和变化的描述正确的是( )
| A. | 常温下,氨水溶液加水稀释,$\frac{c(N{H}_{2}•{H}_{2}O)•c({H}^{+})}{c(N{H}_{4}^{+})}$增大 | |
| B. | 2SO2(g)+O2 (g)?2SO3(g)(△H<0),其它条件不变时,升高温度,v(正)增大、v(逆)减小,平衡正向移动 | |
| C. | 某容器中存在H2(g)+I2 (g)?2HI(g)反应,当减小容器体积时,气体颜色加深,各物质的百分含量不变 | |
| D. | 25℃时Mg(OH)2的Ksp小于MgF2的Ksp,则饱和Mg(OH)2与饱和MgF2相比,前者c(Mg2+)大 |
1.下列物质分类的正确组合是( )
| 分类组合 | 纯净物 | 强电解质 | 盐 | 碱性氧化物 | 分子式 |
| A | 碱石灰 | 氨水 | 纯碱 | 氧化铝 | S8 |
| B | 聚乙烯 | 碳酸钙 | 小苏打 | 氧化镁 | KCl |
| C | H2O2 | 硝酸 | 苏打 | 过氧化钠 | SiO2 |
| D | 无水硫酸铜 | 氯化银 | 碱式碳酸铜 | 氧化钠 | P4 |
| A. | A | B. | B | C. | C | D. | D |
8.下列离子方程式书写正确的是( )
| A. | 用惰性电极电解饱和氯化钠溶液:2Cl-+2H+ $\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑ | |
| B. | NaHS溶液呈碱性:HS-+H3O+?H2S+H2O | |
| C. | 过量CO2通入Ca(ClO)2溶液中 ClO-+CO2+H2O=HCO3-+HClO | |
| D. | 向Na2CO3溶液中加入过量CH3COOH溶液 CO32-+2H+=CO2↑+H2O |
18. 一定条件下,在2L密闭容器中加入等物质的量的FeO和CO,发生下列反应FeO(s)+CO(g)═Fe(s)+CO2(g),在T1、T2温度下,物质的量n随时间t变化的曲线如图所示,下列叙述正确的是( )
一定条件下,在2L密闭容器中加入等物质的量的FeO和CO,发生下列反应FeO(s)+CO(g)═Fe(s)+CO2(g),在T1、T2温度下,物质的量n随时间t变化的曲线如图所示,下列叙述正确的是( )
 一定条件下,在2L密闭容器中加入等物质的量的FeO和CO,发生下列反应FeO(s)+CO(g)═Fe(s)+CO2(g),在T1、T2温度下,物质的量n随时间t变化的曲线如图所示,下列叙述正确的是( )
一定条件下,在2L密闭容器中加入等物质的量的FeO和CO,发生下列反应FeO(s)+CO(g)═Fe(s)+CO2(g),在T1、T2温度下,物质的量n随时间t变化的曲线如图所示,下列叙述正确的是( )| A. | 平衡前,随着反应的进行,容器内气体的相对分子质量始终不变 | |
| B. | 平衡时,其他条件不变,取出适当铁可提高CO的转化率 | |
| C. | 该反应的△H<0,K1<K2=1.5 | |
| D. | 当反应进行到t1时刻仅改变一个条件,可能是通入了氮气 |
5.化学在环境保护中起着十分重要的作用,电化学降解NO3-的原理如图所示.下列说法不正确的是( )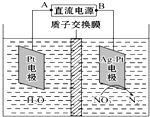

| A. | A为电源的正极 | |
| B. | 溶液中H+从阳极向阴极迁移 | |
| C. | 阴极反应式为2 NO3-+12H++10e-=N2↑+6H20 | |
| D. | 若电解过程中转移了2 mol电子,则左侧电解液的质量减少了16g |
2.下列装置或操作能达到实验目的是( )

| A. | 实验Ⅰ:酸性KMnO4溶液中出现气泡,且颜色逐渐褪去 | |
| B. | 实验Ⅱ:中和热测定 | |
| C. | 实验Ⅲ:可用来制取并收集NO2 | |
| D. | 实验Ⅳ:可用于HCl气体的吸收 |