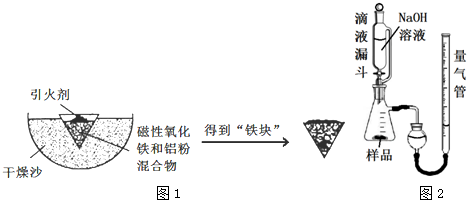
题目内容
1.下列物质分类的正确组合是( )| 分类组合 | 纯净物 | 强电解质 | 盐 | 碱性氧化物 | 分子式 |
| A | 碱石灰 | 氨水 | 纯碱 | 氧化铝 | S8 |
| B | 聚乙烯 | 碳酸钙 | 小苏打 | 氧化镁 | KCl |
| C | H2O2 | 硝酸 | 苏打 | 过氧化钠 | SiO2 |
| D | 无水硫酸铜 | 氯化银 | 碱式碳酸铜 | 氧化钠 | P4 |
| A. | A | B. | B | C. | C | D. | D |
分析 只由一种物质构成的是纯净物;碱性氧化物是指能和酸反应生成盐和水的氧化物;盐是指能电离出金属阳离子(铵根离子)和酸根阴离子的化合物;
强电解质是指在水溶液中或熔融状态下能完全电离的电解质,据此分析解答.
解答 解:A、碱石灰是氢氧化钠和氧化钙的混合物,氨水属于混合物,不是电解质,氧化铝是两性氧化物,故A错误;
B、聚乙烯是混合物,故B错误;
C、过氧化钠和酸反应生成氯化钠、水以及氧气,不是碱性氧化物,二氧化硅是原子晶体,SiO2不是其分子式,故C错误;
D、无水硫酸铜是纯净物,氯化银是盐,属于强电解质,碱式碳酸铜属于碱式盐,氧化钠和酸反应生成盐和水,属于碱性氧化物,白磷的分子式为:P4,故D正确.
故选D.
点评 本题考查了纯净物、碱性氧化物和酸性氧化物和强电解质的概念,根据概念的实质来分析,难度不大.

练习册系列答案
相关题目
12.将51.2g Cu完全溶于适量浓硝酸中,收集到氮的氧化物(含NO、N2O4、NO2)的混合物,这些气体恰好被500mL 2.0mol/L NaOH溶液完全吸收,生成含NaNO3和NaNO2的盐溶液,其中NaNO2的物质的量是( )
| A. | 0.2 mol | B. | 0.4 mol | C. | 0.6 mol | D. | 0.8 mol |
9.请根据题意,选择恰当的选项用字母代号填空.
(1)根据如表左边的“实验操作”,从右边的“实验现象”中选择正确的字母代号,填人对应“答案”的空格中.
(2)现有:A.铁锅;B、鸡蛋;C、白酒;D、乙烯.根据所学知识,请你在上述四种物质中选择合适的物质填入下列空格中(填编号)
①可以作为水果催熟剂的是D; ②富含乙醇的是C;
③在潮湿的空气中会生锈的是A; ④富含蛋白质的是B.
(3)青霉素是最重要的抗生素.青霉素在人体内经酸性水解后,得到青霉素氨基酸,其结构简式如图所示:
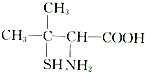
青霉素氨基酸中含有的官能团的名称为氨基、羧基.
(1)根据如表左边的“实验操作”,从右边的“实验现象”中选择正确的字母代号,填人对应“答案”的空格中.
| 实验操作 | 答案 | 实验现象 |
| ①向鸡蛋清溶液里加入饱和硫酸铵溶液 | A.呈蓝色 B.呈黄色 C、析出白色沉淀 D.出现光亮的银镜 | |
| ②向银氨溶液中加人葡萄糖溶液后水浴加热 | ||
| ③向鸡蛋清溶液里滴加浓硝酸后微热 | ||
| ④向士豆片上滴加碘水 |
①可以作为水果催熟剂的是D; ②富含乙醇的是C;
③在潮湿的空气中会生锈的是A; ④富含蛋白质的是B.
(3)青霉素是最重要的抗生素.青霉素在人体内经酸性水解后,得到青霉素氨基酸,其结构简式如图所示:

青霉素氨基酸中含有的官能团的名称为氨基、羧基.
6.日常生活中常用到化学知识,下列说法不正确的是( )
| A. | 赤潮、白色污染、绿色食品中的“赤”“白”“绿”均指相关物质的颜色 | |
| B. | 聚氯乙烯塑料有毒,不可用于制食品包装袋 | |
| C. | 明矾溶于水生成的Al (OH)3胶体,可除去水中的悬浮颗粒等杂质 | |
| D. | 新制的Cu(OH)2可以测定糖尿病患者尿中萄葡糖的含量 |
13.某试液中只可能含有K+、NH4+、Fe2+、Al3+、Cl-、SO42-、CO32-、AlO2- 中的若干种离子,离子浓度均为0.1mol•L-1,某同学进行了如下实验:
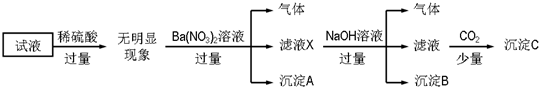
下列说法不正确的是( )

下列说法不正确的是( )
| A. | 沉淀A是BaSO4,说明原试液中一定含有SO42- | |
| B. | 滤液X中大量存在的阳离子有NH4+、Fe3+和Ba2+ | |
| C. | 沉淀C只有一种成分 | |
| D. | 原溶液中一定大量存在的离子只有:NH4+、Fe2+、Cl-、SO42- |
10.常温下,下列离子浓度关系或结论正确的是( )
| A. | 将0.1mol/L氨水与0.1 mol/L稀盐酸等体积混合:c(NH4+)>c(Cl-)>c(H+)>c(OH-) | |
| B. | 将pH=2 的稀盐酸与pH=12的氨水等体积混合,所得溶液pH>7 | |
| C. | 0.10 mol•L-1的氨水用HNO3溶液完全中和后,溶液显中性 | |
| D. | 用惰性电极电解稀硫酸时,实质是电解水,溶液的pH不变 |