题目内容
3.为测定漂白粉中Ca(ClO)2的质量分数,该小组用2.0g漂白粉配制成250mL溶液,取出25mL并向其中依次加入过量稀硫酸、过量KI溶液,完全反应后,再滴入0.1mol/L的Na2S2O3溶液:2Na2S2O3+I2═Na2S4O6+2NaI,共消耗20mL Na2S2O3溶液,则漂白粉中Ca(ClO)2的质量分数是多少?分析 将方程式相加后使次氯酸钙和硫代硫酸钠在同一方程式中,根据次氯酸钙和硫代硫酸钠之间的关系式计算次氯酸钙的质量,然后根据质量分数公式计算即可.
解答 将2.0g漂白粉配制成250mL溶液,取出25mL溶液,所以25mL溶液中漂白粉的质量为:2.0g×$\frac{1}{10}$=0.2g,
Ca(ClO)2+4KI+2H2SO4=CaCl2+2K2SO4+2H2O+2I2 ①
2Na2S2O3+I2=Na2S4O6+2NaI②
设次氯酸钠的质量为x,根据反应①②可得关系式:
Ca(ClO)2~4Na2S2O3
143g 4mol
x 0.1mol•L-1×0.02L
则:x=$\frac{143g×0.1mol/L×0.02L}{4mol}$=0.0715g,
所以漂白粉中Ca(ClO)2的质量分数为:$\frac{0.0715g}{0.2g}$×100%=35.75%,
答:漂白粉中Ca(ClO)2的质量分数是35.75%.
点评 本题考查了混合物反应的计算,题目难度中等,明确发生反应原理为解答关键,注意配制的溶液体积与滴定时溶液的体积关系,掌握关系式法在化学计算中的应用,试题充分考查学生的分析、理解能力及化学计算能力,

练习册系列答案
相关题目
13.某试液中只可能含有K+、NH4+、Fe2+、Al3+、Cl-、SO42-、CO32-、AlO2- 中的若干种离子,离子浓度均为0.1mol•L-1,某同学进行了如下实验:
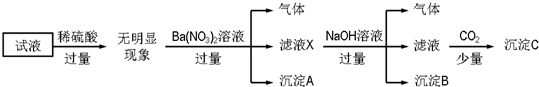
下列说法不正确的是( )

下列说法不正确的是( )
| A. | 沉淀A是BaSO4,说明原试液中一定含有SO42- | |
| B. | 滤液X中大量存在的阳离子有NH4+、Fe3+和Ba2+ | |
| C. | 沉淀C只有一种成分 | |
| D. | 原溶液中一定大量存在的离子只有:NH4+、Fe2+、Cl-、SO42- |
18.用惰性电极电解1L 0.2mol/L的CuSO4溶液,电解过程中转移电子数为0.6mol,向所得溶液中加入一定量的下列某种物质后恰好恢复到电解前的浓度和pH,则该物质为( )
| A. | Cu(OH)2 | B. | CuCO3 | C. | CuCO3•CuO | D. | Cu2(OH)2CO3 |
9.下列排列顺序错误的是( )
| A. | 非金属性:S>Cl>F | B. | 碱性:NaOH>Mg( 0H)2>Al( 0H)3 | ||
| C. | 稳定性:PH3<H2S<HF | D. | 离子半径:02->Na+>Mg2+ |
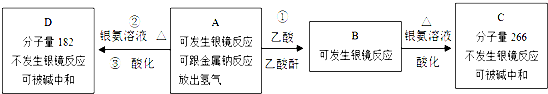
 、C
、C
 +2[Ag(NH3)2]OH$\stackrel{△}{→}$
+2[Ag(NH3)2]OH$\stackrel{△}{→}$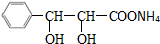 +3NH3+2Ag↓+H2O
+3NH3+2Ag↓+H2O (或
(或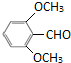 )
)
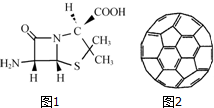 在人类文明的历程中,许多物质发挥过重要作用,如铁、硝酸钾、青霉素、聚乙烯、二氧化硅、富勒烯、含铬物质等.
在人类文明的历程中,许多物质发挥过重要作用,如铁、硝酸钾、青霉素、聚乙烯、二氧化硅、富勒烯、含铬物质等.