题目内容
8.下列离子方程式书写正确的是( )| A. | 用惰性电极电解饱和氯化钠溶液:2Cl-+2H+ $\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑ | |
| B. | NaHS溶液呈碱性:HS-+H3O+?H2S+H2O | |
| C. | 过量CO2通入Ca(ClO)2溶液中 ClO-+CO2+H2O=HCO3-+HClO | |
| D. | 向Na2CO3溶液中加入过量CH3COOH溶液 CO32-+2H+=CO2↑+H2O |
分析 A.氢离子来自水的电离,水应该保留分子式;
B.硫氢根离子部分水解生成硫化氢和氢氧根离子,溶液显示碱性;
C.二氧化碳过量,反应生成碳酸氢钙和次氯酸;
D.醋酸为弱酸,离子方程式中醋酸不能拆开.
解答 解:A.惰性电极电解饱和氯化钠溶液,生成NaOH、氢气、氯气,正确的离子反应为:2H2O+2Cl-$\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑+2OH-,故A错误;
B.NaHS溶液呈碱性的原因是硫氢根离子部分水解所致,正确的离子方程式为:HS-+H2O?H2S+OH-,故B错误;
C.过量CO2通入Ca(ClO)2溶液中,反应生成碳酸氢钙和次氯酸,反应的离子方程式为:ClO-+CO2+H2O=HCO3-+HClO,故C正确;
D.醋酸为弱酸,离子方程式中应该保留分子式,正确的离子方程式为:CO32-+2CH3COOH=H2O+CO2↑+2CH3COO-,故D错误;
故选C.
点评 本题考查离子反应方程式的书写,题目难度中等,明确发生的化学反应的实质为解答本题的关键,注意掌握水解原理与弱电解质的电离的区别,试题培养了学生灵活应用基础知识的能力.

练习册系列答案
相关题目
3.设NA代表阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 已知白磷(P4)为正四面体形,12.4 g白磷中则含有共价键数为0.4 NA | |
| B. | 3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$ Fe3O4+4H2反应中,当5.6 g Fe全部转化为Fe3O4时,则有0.3 NA电子发生转移 | |
| C. | 在0.1 mol/L碳酸钠溶液中Na+总数等于0.2 NA | |
| D. | 电解精炼铜时,当电路中转移NA个电子时,阴极增重32g |
13.某试液中只可能含有K+、NH4+、Fe2+、Al3+、Cl-、SO42-、CO32-、AlO2- 中的若干种离子,离子浓度均为0.1mol•L-1,某同学进行了如下实验:
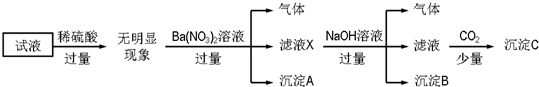
下列说法不正确的是( )

下列说法不正确的是( )
| A. | 沉淀A是BaSO4,说明原试液中一定含有SO42- | |
| B. | 滤液X中大量存在的阳离子有NH4+、Fe3+和Ba2+ | |
| C. | 沉淀C只有一种成分 | |
| D. | 原溶液中一定大量存在的离子只有:NH4+、Fe2+、Cl-、SO42- |
20.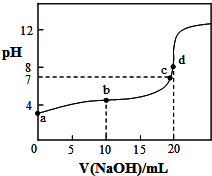 室温下,将0.1000mol/LNaOH溶液滴入20.00ml 0.1000mol/L CH3COOH溶液中,溶液pH随加入NaOH溶液体积变化曲线如图所示.下列有关说法正确的是( )
室温下,将0.1000mol/LNaOH溶液滴入20.00ml 0.1000mol/L CH3COOH溶液中,溶液pH随加入NaOH溶液体积变化曲线如图所示.下列有关说法正确的是( )
 室温下,将0.1000mol/LNaOH溶液滴入20.00ml 0.1000mol/L CH3COOH溶液中,溶液pH随加入NaOH溶液体积变化曲线如图所示.下列有关说法正确的是( )
室温下,将0.1000mol/LNaOH溶液滴入20.00ml 0.1000mol/L CH3COOH溶液中,溶液pH随加入NaOH溶液体积变化曲线如图所示.下列有关说法正确的是( )| A. | a点:由水电离出的c(H+)=1.0×10-3mol/L | |
| B. | b点:c(CH3COO-)>c(CH3COOH)>c(Na+)>c(H+)>c(OH-) | |
| C. | c点:c(Na+)=c(CH3COOH)+c(CH3COO-) | |
| D. | d点:c(OH-)-c(H+)=c(CH3COOH) |
18.用惰性电极电解1L 0.2mol/L的CuSO4溶液,电解过程中转移电子数为0.6mol,向所得溶液中加入一定量的下列某种物质后恰好恢复到电解前的浓度和pH,则该物质为( )
| A. | Cu(OH)2 | B. | CuCO3 | C. | CuCO3•CuO | D. | Cu2(OH)2CO3 |
 .
.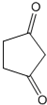 +CH2=CH-NO2$\stackrel{一定条件}{→}$
+CH2=CH-NO2$\stackrel{一定条件}{→}$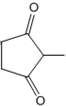 CH2CH2NO2
CH2CH2NO2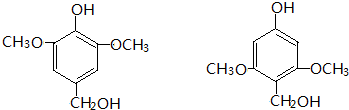 .
.
 锂锰电池的体积小,性能优良,是常用的一次电池.该电池反应原理如图所示,其中电解质LiClO4溶于混合有机溶剂中,Li+ 通过电解质可以自由迁移,正极反应式为:MnO2+Li++e-=LiMnO2.回答下列问题:
锂锰电池的体积小,性能优良,是常用的一次电池.该电池反应原理如图所示,其中电解质LiClO4溶于混合有机溶剂中,Li+ 通过电解质可以自由迁移,正极反应式为:MnO2+Li++e-=LiMnO2.回答下列问题: