题目内容
3.下列说法正确的是( )| A. | 配制FeCl3溶液时,可加入少量的稀硫酸以抑制Fe3+的水解 | |
| B. | MgCl2溶液中混有少量FeCl3杂质,可向混合溶液中加入MgO以除杂 | |
| C. | 氯化铝溶液蒸干灼烧得到的固体物质还是氯化铝 | |
| D. | 无色透明溶液中,Na+、Al3+、SO42-、Cl-、ClO-、I-能大量共存 |
分析 A.加硫酸会引入杂质;
B.三价铁离子易水解,加MgO溶液的pH会增大;
C.加热氯化铝溶液,促进水解;
D.ClO-与I-能发生氧化还原反应.
解答 解:A.配制FeCl3溶液时,可加入少量的盐酸以抑制Fe3+的水解,加硫酸会引入杂质,故A错误;
B.三价铁离子易水解,加MgO溶液的pH会增大,铁离子转化为氢氧化铁沉淀,过滤即可除去,故B正确;
C.加热氯化铝溶液,促进水解,生成氢氧化铝和HCl,HCl易挥发,最后得到氢氧化铝,灼烧得到氧化铝,故C错误;
D.ClO-与I-能发生氧化还原反应,所以无色透明溶液中,Na+、Al3+、SO42-、Cl-、ClO-、I-不能大量共存,故D错误.
故选B.
点评 本题考查了盐的水解原理应用、离子共存,题目难度不大,注意把握盐的水解规律、以及判断离子能否共存的方法.

练习册系列答案
 科学实验活动册系列答案
科学实验活动册系列答案
相关题目
9.下列实验操作对应的实验现象及解释或结论都正确的是( )
| 选项 | 实验操作 | 实验现象 | 解释或结论 |
| A | 用某无色溶液进行焰色反应 | 焰色呈黄色 | 原溶液一定是钠盐溶液 |
| B | 向NaOH溶液中滴加足量的MgCl2 溶液,然后再滴加足量的CuCl2溶液 | 先产生白色沉淀, 然后沉淀变蓝色 | KSP[Cu(OH)2]>KSP[Mg(OH)2] |
| C | 将水蒸汽通过灼热的铁粉 | 粉末变红 | 铁与水蒸汽在高温下发生 反应 |
| D | 将充满NO2的密闭玻璃球浸泡在热水中 | 红棕色变深 | 反应2NO2(g)═N2O4(g) △H<0 |
| A. | A | B. | B | C. | C | D. | D |
15.下列说法不正确的是( )
| A. | 在用简易量热计测定反应热时,可使用碎泡沫起隔热保温的作用、普通玻璃棒进行搅拌使酸和碱充分反应、准确读取实验时温度计最高温度、并且取2-3 次的实验平均值等措施,以达到良好的实验效果 | |
| B. | 容量瓶、量筒和滴定管上都标有使用温度;量筒、容量瓶无“0”刻度,滴定管有“0”刻度;使用时滴定管水洗后还需润洗,但容量瓶水洗后不用润洗 | |
| C. | pH计能用于酸碱中和滴定终点的判断 | |
| D. | 在4mL0.1mol•L-1的K2Cr2O7溶液中滴加数滴1mol•L-1的NaOH溶液,溶液颜色从橙色变成黄色 |
12.将51.2g Cu完全溶于适量浓硝酸中,收集到氮的氧化物(含NO、N2O4、NO2)的混合物,这些气体恰好被500mL 2.0mol/L NaOH溶液完全吸收,生成含NaNO3和NaNO2的盐溶液,其中NaNO2的物质的量是( )
| A. | 0.2 mol | B. | 0.4 mol | C. | 0.6 mol | D. | 0.8 mol |
13.某试液中只可能含有K+、NH4+、Fe2+、Al3+、Cl-、SO42-、CO32-、AlO2- 中的若干种离子,离子浓度均为0.1mol•L-1,某同学进行了如下实验:
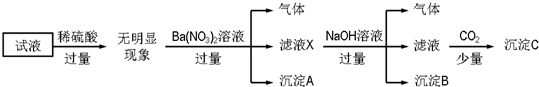
下列说法不正确的是( )

下列说法不正确的是( )
| A. | 沉淀A是BaSO4,说明原试液中一定含有SO42- | |
| B. | 滤液X中大量存在的阳离子有NH4+、Fe3+和Ba2+ | |
| C. | 沉淀C只有一种成分 | |
| D. | 原溶液中一定大量存在的离子只有:NH4+、Fe2+、Cl-、SO42- |
 碳、氢、氧 3 种元素组成的有机物A,相对分子质量为 102,含氢的质量分数为9.8%,分子中氢原子个数为氧的 5 倍.
碳、氢、氧 3 种元素组成的有机物A,相对分子质量为 102,含氢的质量分数为9.8%,分子中氢原子个数为氧的 5 倍. 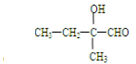 .
.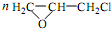 +CH2Cl+nOHCH2CH2OH$\stackrel{一定条件}{→}$
+CH2Cl+nOHCH2CH2OH$\stackrel{一定条件}{→}$ +nHCl
+nHCl