题目内容
4.下列对各平衡体系的建立和变化的描述正确的是( )| A. | 常温下,氨水溶液加水稀释,$\frac{c(N{H}_{2}•{H}_{2}O)•c({H}^{+})}{c(N{H}_{4}^{+})}$增大 | |
| B. | 2SO2(g)+O2 (g)?2SO3(g)(△H<0),其它条件不变时,升高温度,v(正)增大、v(逆)减小,平衡正向移动 | |
| C. | 某容器中存在H2(g)+I2 (g)?2HI(g)反应,当减小容器体积时,气体颜色加深,各物质的百分含量不变 | |
| D. | 25℃时Mg(OH)2的Ksp小于MgF2的Ksp,则饱和Mg(OH)2与饱和MgF2相比,前者c(Mg2+)大 |
分析 A、$\frac{c(N{H}_{2}•{H}_{2}O)•c({H}^{+})}{c(N{H}_{4}^{+})}$=$\frac{{K}_{w}}{{K}_{b}}$;
B、升温正逆反应速率都增大;
C、反应H2(g)+I2 (g)?2HI(g)是反应前后气体体积不变的反应,加压平衡不移动;
D、根据氢氧化镁与氟化镁的化学式相似,由题中数据可知氢氧化镁的溶度积小,其饱和溶液中Mg2+浓度较小;
解答 解:A、$\frac{c(N{H}_{2}•{H}_{2}O)•c({H}^{+})}{c(N{H}_{4}^{+})}$=$\frac{{K}_{w}}{{K}_{b}}$,温度不变,其值不变,故A错误;
B、升温时正逆反应速率都增大,故B错误;
C、加压平衡不移动,但各组分浓度增大,气体颜色加深,各物质的百分含量不变,故C正确;
D、因氢氧化镁溶度积小,由Ksp计算则其Mg2+浓度小,故D错误;
故选C.
点评 本题考查了电离平衡常数和水的离子积常数只受温度影响、影响反应速率的因素、影响平衡移动的因素、难溶电解质的溶解平衡,题目难度不大.

练习册系列答案
 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案
相关题目
15.下列说法不正确的是( )
| A. | 在用简易量热计测定反应热时,可使用碎泡沫起隔热保温的作用、普通玻璃棒进行搅拌使酸和碱充分反应、准确读取实验时温度计最高温度、并且取2-3 次的实验平均值等措施,以达到良好的实验效果 | |
| B. | 容量瓶、量筒和滴定管上都标有使用温度;量筒、容量瓶无“0”刻度,滴定管有“0”刻度;使用时滴定管水洗后还需润洗,但容量瓶水洗后不用润洗 | |
| C. | pH计能用于酸碱中和滴定终点的判断 | |
| D. | 在4mL0.1mol•L-1的K2Cr2O7溶液中滴加数滴1mol•L-1的NaOH溶液,溶液颜色从橙色变成黄色 |
12.将51.2g Cu完全溶于适量浓硝酸中,收集到氮的氧化物(含NO、N2O4、NO2)的混合物,这些气体恰好被500mL 2.0mol/L NaOH溶液完全吸收,生成含NaNO3和NaNO2的盐溶液,其中NaNO2的物质的量是( )
| A. | 0.2 mol | B. | 0.4 mol | C. | 0.6 mol | D. | 0.8 mol |
9.请根据题意,选择恰当的选项用字母代号填空.
(1)根据如表左边的“实验操作”,从右边的“实验现象”中选择正确的字母代号,填人对应“答案”的空格中.
(2)现有:A.铁锅;B、鸡蛋;C、白酒;D、乙烯.根据所学知识,请你在上述四种物质中选择合适的物质填入下列空格中(填编号)
①可以作为水果催熟剂的是D; ②富含乙醇的是C;
③在潮湿的空气中会生锈的是A; ④富含蛋白质的是B.
(3)青霉素是最重要的抗生素.青霉素在人体内经酸性水解后,得到青霉素氨基酸,其结构简式如图所示:
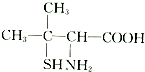
青霉素氨基酸中含有的官能团的名称为氨基、羧基.
(1)根据如表左边的“实验操作”,从右边的“实验现象”中选择正确的字母代号,填人对应“答案”的空格中.
| 实验操作 | 答案 | 实验现象 |
| ①向鸡蛋清溶液里加入饱和硫酸铵溶液 | A.呈蓝色 B.呈黄色 C、析出白色沉淀 D.出现光亮的银镜 | |
| ②向银氨溶液中加人葡萄糖溶液后水浴加热 | ||
| ③向鸡蛋清溶液里滴加浓硝酸后微热 | ||
| ④向士豆片上滴加碘水 |
①可以作为水果催熟剂的是D; ②富含乙醇的是C;
③在潮湿的空气中会生锈的是A; ④富含蛋白质的是B.
(3)青霉素是最重要的抗生素.青霉素在人体内经酸性水解后,得到青霉素氨基酸,其结构简式如图所示:

青霉素氨基酸中含有的官能团的名称为氨基、羧基.
13.某试液中只可能含有K+、NH4+、Fe2+、Al3+、Cl-、SO42-、CO32-、AlO2- 中的若干种离子,离子浓度均为0.1mol•L-1,某同学进行了如下实验:
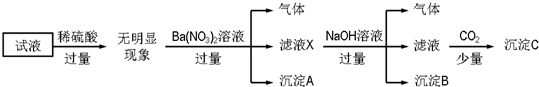
下列说法不正确的是( )

下列说法不正确的是( )
| A. | 沉淀A是BaSO4,说明原试液中一定含有SO42- | |
| B. | 滤液X中大量存在的阳离子有NH4+、Fe3+和Ba2+ | |
| C. | 沉淀C只有一种成分 | |
| D. | 原溶液中一定大量存在的离子只有:NH4+、Fe2+、Cl-、SO42- |
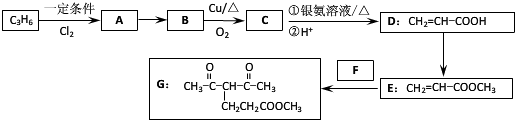
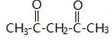 .
.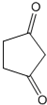 +CH2=CH-NO2$\stackrel{一定条件}{→}$
+CH2=CH-NO2$\stackrel{一定条件}{→}$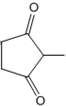 CH2CH2NO2
CH2CH2NO2 .
.
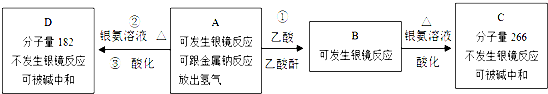
 、C
、C
 +2[Ag(NH3)2]OH$\stackrel{△}{→}$
+2[Ag(NH3)2]OH$\stackrel{△}{→}$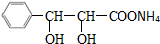 +3NH3+2Ag↓+H2O
+3NH3+2Ag↓+H2O (或
(或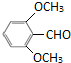 )
)