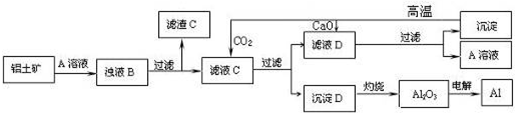
题目内容
10. 碳及其化合物的研究具有重要的现实意义
碳及其化合物的研究具有重要的现实意义(1)用电弧法合成的储氢纳米碳管常伴有大量的碳纳米颗粒(杂质),这种颗粒可用如下氧化法提纯:5C+4KMnO4+6H2SO4→5CO2↑+4K2SO4+2MnSO4+6H2O请完成并配平上述化学方程式.
(2)活性炭可处理大气污染物NO.在2L密闭容器中加入NO和活性炭(无杂质),生成气体E和F.当温度分别在T1和T2时,测得各物质平衡时物质的量如下表:
| 物质 T/℃n/mol T/℃ | 活性炭 | NO | E | F |
| 初始 | 2.030 | 0.100 | 0 | 0 |
| T1 | 2.000 | 0.040 | 0.030 | 0.030 |
| T2 | 2.005 | 0.050 | 0.025 | 0.025 |
 N2+CO2.
N2+CO2.②上述反应T1℃时的平衡常数为K1,T2℃时的平衡常数为K2.
Ⅰ.计算K1=0.5625.
Ⅱ.根据上述信息判断,温度T1和T2的关系是(填序号)c.
a.T1>T2 b.T1<T2 c.无法比较
③在T1温度下反应达到平衡后,下列措施不能改变NO转化率的是bc.
a.升高温度 b.增大压强 c.增大c(NO)
(3)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=-1275.6kJ/mol
②2CO (g)+O2(g)=2CO2(g)△H=-566.0kJ/mol
③H2O(g)=H2O(l)△H=-44.0kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-442.8kJ/mol;
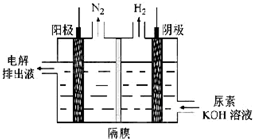
(4)电解尿素[CO(NH2)2]的碱性溶液可以制取氢气,其装置如图所示(电解池中隔膜仅阻止气体通过,阴、阳极均为惰性电极).电解时,阳极的电极反应式为CO(NH2)2+8OH--6e-=CO32-+N2↑+6H2O.
分析 (1)根据氧化还原反应中得失电子数相等和原子守恒来配平化学方程式;
(2)①依据表中数据计算反应物、生成物转化量,依据转化量之比等于计量系数之比,结合原子个数守恒书写方程式;
②计算各气体的平衡浓度,代入平衡常数表达式计算;
由表中数据可知,温度由T1变为T2,平衡向逆反应移动,由于正反应是吸热,还是放热不确定,不能判断温度变化;
③依据平衡移动的原理解答:升高温度平衡向吸热方向移动,增大压强平衡向气体系数小的方向移动,增大反应物浓度,平衡向正方向移动;
(3)依据盖斯定律计算反应热,写出反应的热化学方程式;
(4)电解时,阳极尿素失去电子发生氧化反应生成碳酸根、氮气和水.
解答 解:(1)方程式中高锰酸钾中锰元素化合价从+7价降低为+2价,降低5价,碳元素化合价从0价升高到+4价,升高4价,依据氧化还原反应中化合价升高数=化合价降低数,所以高锰酸钾前的系数是4,碳单质前的系数是5,根据原子守恒,二氧化碳前是5,硫酸锰前是4,硫酸钾前面是2,根据原子个数守恒,所以硫酸前面是6,据氧原子和氢原子守恒,
故答案为:5、4、6 H2SO4、5、4、2、6;
(2)①由表中数据可知,C、NO、E、F的化学计量数之比为0.03:0.06:0.03:0.03=1:2:1:1,反应中C被氧化,结合原子守恒可知,生成为N2与CO2,且该反应为可逆反应,故反应方程式为:C+2NO?N2+CO2,
故答案为:C+2NO  N2+CO2;
N2+CO2;
②T1℃时的平衡浓度c(NO)=$\frac{0.04mol}{1L}$=0.04mol/L,c(N2)=c(CO2)=$\frac{0.03mol}{1L}$=0.03mol/L,故T1℃时该反应的平衡常数为K1=$\frac{0.03×0.03}{0.0{4}^{2}}$=0.5625,
故答案为:0.5625;
由表中数据可知,温度由T1变为T2,平衡向逆反应移动,由于正反应是吸热,还是放热不确定,无法判断温度变化,
故选:a;
③a.反应移动存在热效应,升高温度,平衡一定移动,NO转化率一定变化,故a不符合;
b.该反应前后气体的物质的量不变,增大压强,平衡不移动,NO转化率不变,故b选;
c.增大c(NO),相当于增大压强,该反应前后气体的物质的量不变,平衡不移动,NO的转化率不变,故c选;
故选:bc;
(3)①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H1=-1275.6kJ/mol
②2CO (g)+O2(g)=2CO2(g)△H2=-566.0kJ/mol
③H2O(g)=H2O(l)△H3=-44.0kJ/mol
由盖斯定律①-②+③×4,得:2CH3OH(l)+2O2(g)=2CO (g)+4H2O(l)△H=-885.6KJ/mol;
故答案为:CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-442.8 kJ/mol;
(4)电解时,阳极尿素失去电子发生氧化反应生成碳酸根、氮气和水,电解反应式为:CO(NH2)2+8OH--6e-=CO32-+N2↑+6H2O;
故答案为:CO(NH2)2+8OH--6e-=CO32-+N2↑+6H2O.
点评 本题考查氧化还原反应方程式的书写、平衡常数及化学平衡的有关计算、平衡的移动等、热化学方程式的书写、电解池电极反应式的书写,题目难度中等,侧重学生对基础知识的掌握熟练程度.

| 结构简式 | 沸点/℃ | 结构简式 | 沸点/℃ |
| CH3CH3 | -88.6 | CH2=CH2 | -103.7 |
| CH3CH2CH3 | -42.2 | CH2=CHCH3 | -47.4 |
| CH3CH2CH2CH3 | -0.5 | CH3CH2CH=CH2 | -6.3 |
 | -11.7 | 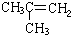 | -6.9 |
| CH3CH2CH2CH2CH3 | 36.1 | CH3CH2CH2CH=CH2 | 30 |
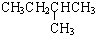 | 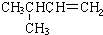 | 20.1 |
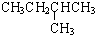 在1.013×105Pa、25℃时的状态是气态(填气态、液态或固态).
在1.013×105Pa、25℃时的状态是气态(填气态、液态或固态).(2)石油裂解是一个复杂的过程,其产物为混合物.例如:
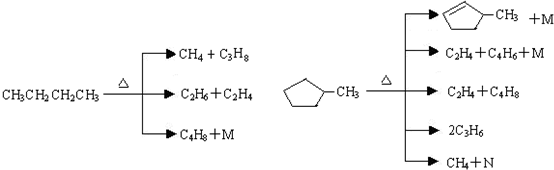
①上述烷烃和环烷烃裂解反应中,产物M的化学式为H2,N的化学式为C5H8.
②下列关于
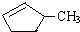 的说法正确的是A.
的说法正确的是A.A.可用溴水区别
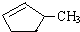 和
和
B.等质量的
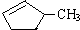 和
和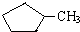 完全燃烧时的耗氧量相同
完全燃烧时的耗氧量相同C.
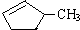 可与水以任意比互溶
可与水以任意比互溶(3)工业上裂解反应的产物都是气态小分子烷烃和烯烃的混合物,将它们逐一分离的方法是降低温度.
| A. | 参加反应的H2和硝酸的物质的量之比为3:1 | |
| B. | 混合物中氧原子的物质的量为0.3mol | |
| C. | 混合物中铁原子的物质的量为0.3mol | |
| D. | 参加反应的硝酸的物质的量为1mol |
| A. | 苯→环已烷 | B. | 乙烯→聚乙烯 | C. | 苯→溴苯 | D. | 甲烷→四氯甲烷 |
| A. | 工业上将硫酸工业尾气SO2持续通入氨水中:SO2+OH-═HSO3- | |
| B. | 向NaAlO2溶液中通入过量CO2:AlO2-+CO2+2H2O═Al(OH)3↓+HCO3- | |
| C. | 用惰性电极电解KOH溶液时阴极电极反应:2H2O-4e-═O2↑+4H+ | |
| D. | NaHSO4溶液和Ba(OH)2溶液充分反应后溶液呈中性:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O |
| A. | C3H8O | B. | C2H6O | C. | C2H4O2 | D. | C4H10 |
 pH=2的A、B两种酸溶液各lmL,分别加水稀释到1000mL,其溶液的pH与溶液体积(V)的关系如图所示,则下列说法正确的是( )
pH=2的A、B两种酸溶液各lmL,分别加水稀释到1000mL,其溶液的pH与溶液体积(V)的关系如图所示,则下列说法正确的是( )| A. | A、B溶液浓度一定相等 | B. | 稀释后A溶液酸性比B溶液强 | ||
| C. | a=5时,A是强酸,B是弱酸 | D. | 若A、B都是弱酸,则2<a=5 |
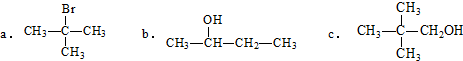
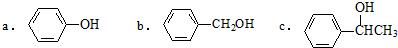
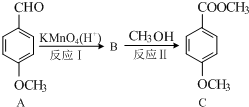
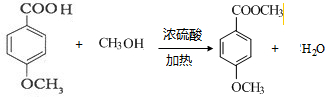 .
. 与O2反应制得,写出该反应的化学方程式
与O2反应制得,写出该反应的化学方程式 .
.