题目内容
19.将有机物完全燃烧,生成CO2和H2O.将6g该有机物的完全燃烧产物通过浓H2SO4,浓H2SO4增重7.2g,再通过碱石灰,又增重13.2g.该有机物分子式为( )| A. | C3H8O | B. | C2H6O | C. | C2H4O2 | D. | C4H10 |
分析 根据浓硫酸和氢氧化钠溶液增重的质量可计算有机物生成的水和二氧化碳的物质的量,根据C元素、H元素守恒和O元素守恒可计算有机物中C、H、O元素的物质的量,进而计算各元素的物质的量之比,最终可计算有机物的分子式.
解答 解:浓硫酸增重可知水的质量为7.2g,则水的物质的量为:n(H2O)=$\frac{7.2g}{18g/mol}$=0.4mol,n(H)=0.8mol,m(H)=0.8g;
氢氧化钠溶液增重13.2g,则二氧化碳质量为:13.2g,n(C)=n(CO2)=$\frac{13.2g}{44g/mol}$=0.3mol,m(C)=3.6g,m(C)+m(H)=4.4g,
有机物的质量为6g,所以该有机物中氧的质量为:6g-4.4g=1.6g,含有氧原子的物质的量为:n(O)=$\frac{1.6g}{16g/mol}$=0.1mol,
所以:n(C):n(H):n(O)=0.3mol:0.8mol:0.1mol=3:8:1,
即该有机物的实验式为:C3H8O,由于C3H8O中碳原子已经饱和,
所以其分子式也为C3H8O,
故选A.
点评 本题考查了分子式的计算,题目难度中等,计算时含有氧原子数时可根据质量守恒来确定和计算,需要注意的是若实验式中碳原子已经饱和,则分子式和实验式相同.

练习册系列答案
相关题目
10. 碳及其化合物的研究具有重要的现实意义
碳及其化合物的研究具有重要的现实意义
(1)用电弧法合成的储氢纳米碳管常伴有大量的碳纳米颗粒(杂质),这种颗粒可用如下氧化法提纯:5C+4KMnO4+6H2SO4→5CO2↑+4K2SO4+2MnSO4+6H2O请完成并配平上述化学方程式.
(2)活性炭可处理大气污染物NO.在2L密闭容器中加入NO和活性炭(无杂质),生成气体E和F.当温度分别在T1和T2时,测得各物质平衡时物质的量如下表:
①请结合上表数据,写出NO与活性炭反应的化学方程式C+2NO N2+CO2.
N2+CO2.
②上述反应T1℃时的平衡常数为K1,T2℃时的平衡常数为K2.
Ⅰ.计算K1=0.5625.
Ⅱ.根据上述信息判断,温度T1和T2的关系是(填序号)c.
a.T1>T2 b.T1<T2 c.无法比较
③在T1温度下反应达到平衡后,下列措施不能改变NO转化率的是bc.
a.升高温度 b.增大压强 c.增大c(NO)
(3)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=-1275.6kJ/mol
②2CO (g)+O2(g)=2CO2(g)△H=-566.0kJ/mol
③H2O(g)=H2O(l)△H=-44.0kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-442.8kJ/mol;
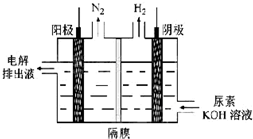
(4)电解尿素[CO(NH2)2]的碱性溶液可以制取氢气,其装置如图所示(电解池中隔膜仅阻止气体通过,阴、阳极均为惰性电极).电解时,阳极的电极反应式为CO(NH2)2+8OH--6e-=CO32-+N2↑+6H2O.
 碳及其化合物的研究具有重要的现实意义
碳及其化合物的研究具有重要的现实意义(1)用电弧法合成的储氢纳米碳管常伴有大量的碳纳米颗粒(杂质),这种颗粒可用如下氧化法提纯:5C+4KMnO4+6H2SO4→5CO2↑+4K2SO4+2MnSO4+6H2O请完成并配平上述化学方程式.
(2)活性炭可处理大气污染物NO.在2L密闭容器中加入NO和活性炭(无杂质),生成气体E和F.当温度分别在T1和T2时,测得各物质平衡时物质的量如下表:
| 物质 T/℃n/mol T/℃ | 活性炭 | NO | E | F |
| 初始 | 2.030 | 0.100 | 0 | 0 |
| T1 | 2.000 | 0.040 | 0.030 | 0.030 |
| T2 | 2.005 | 0.050 | 0.025 | 0.025 |
 N2+CO2.
N2+CO2.②上述反应T1℃时的平衡常数为K1,T2℃时的平衡常数为K2.
Ⅰ.计算K1=0.5625.
Ⅱ.根据上述信息判断,温度T1和T2的关系是(填序号)c.
a.T1>T2 b.T1<T2 c.无法比较
③在T1温度下反应达到平衡后,下列措施不能改变NO转化率的是bc.
a.升高温度 b.增大压强 c.增大c(NO)
(3)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=-1275.6kJ/mol
②2CO (g)+O2(g)=2CO2(g)△H=-566.0kJ/mol
③H2O(g)=H2O(l)△H=-44.0kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-442.8kJ/mol;
(4)电解尿素[CO(NH2)2]的碱性溶液可以制取氢气,其装置如图所示(电解池中隔膜仅阻止气体通过,阴、阳极均为惰性电极).电解时,阳极的电极反应式为CO(NH2)2+8OH--6e-=CO32-+N2↑+6H2O.
7.含下列溶质的稀溶液中,插入两支惰性电极通直流电一段时间后,溶液的pH值增大的是( )
| A. | NaOH | B. | H2SO4 | C. | AgNO3 | D. | Na2SO4 |
11.现有由两种可溶性化合物配成的混合溶液,且浓度均为0.1mol•L-1,其中阳离子可能是Fe2+、Al3+、Fe3+、H+,阴离子可能是NO3-、CO32-、I-、Cl-.若向溶液中加少量盐酸,则溶液变成黄色,且有气体生成.若不计水电离产生的少量离子,则下列说法一定正确的是:( )
| A. | 向溶液中加少量盐酸时,生成的气体可能含有CO2 | |
| B. | 原溶液中一定含有NO3-、Fe2+,一定不含Fe3+、H+、CO32- | |
| C. | 原溶液中一定含有的离子为NO3-,可能含有Fe2+、I- | |
| D. | 若原溶液中逐滴加入NaOH溶液,沉淀的量先增加后减少 |
8.下列说法中正确的是( )
| A. | 在化学反应中一定有新物质生成,同时也一定有能量的变化 | |
| B. | 在化学反应中一定有新物质生成,但不一定有能量的变化 | |
| C. | 在化学反应中不一定有化学键的变化 | |
| D. | 在化学反应中一定有化学键的变化,但不一定有能量的变化 |
9.下列叙述中,正确的是( )
| A. | 化学反应中物质变化的实质是旧化学键的断裂和新化学键的形成 | |
| B. | 离子化合物中一定含有金属元素 | |
| C. | 化学键是物质中原子间强烈的相互作用 | |
| D. | 共价化合物中各原子都一定满足最外层8电子稳定结构 |
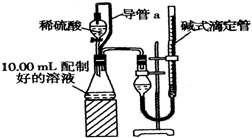 实验室测定碳酸钠和碳酸氢钠混合物中碳酸钠的质量分数W(Na2CO3),称取此混合物5.0g,溶于水中,配成250mL溶液
实验室测定碳酸钠和碳酸氢钠混合物中碳酸钠的质量分数W(Na2CO3),称取此混合物5.0g,溶于水中,配成250mL溶液