题目内容
3.m g Fe、Fe3O4、Fe2O3的混合物用足量H2还原,固体质量减少4.8g;若将等质量的混合物加入足量的稀硝酸中,产生2.24LNO气体(标准状况下).有关该混合物的下列说法不正确的是( )| A. | 参加反应的H2和硝酸的物质的量之比为3:1 | |
| B. | 混合物中氧原子的物质的量为0.3mol | |
| C. | 混合物中铁原子的物质的量为0.3mol | |
| D. | 参加反应的硝酸的物质的量为1mol |
分析 m g Fe、Fe3O4、Fe2O3的混合物可以看作Fe、FeO、Fe2O3混合物,用足量H2还原得到Fe与H2O,固体质量减少4.8g为混合物中氧元素质量,氧原子物质的量为0.3mol,若将等质量的混合物加入足量的稀硝酸中,反应得到Fe(NO3)3,同时产生2.24LNO气体(标准状况下),其物质的量为0.1mol,设Fe、FeO、Fe2O3的物质的量分别为xmol、ymol、zmol,根据氧原子守恒有y+3z=0.3,根据电子转移守恒有:3x+y=0.1×3,整理可得x=z,即Fe、FeO、Fe2O3混合物中Fe、Fe2O3的物质的量之比为1:1,则原混合物可以看作FeO,且n(FeO)=n(O)=0.3mol.
根据氧原子、H原子守恒计算参加反应氢气物质的量,反应中硝酸起氧化剂、酸性作用,根据Fe原子守恒计算起酸性作用的硝酸,根据N原子守恒计算起氧化剂作用的硝酸,再根据N原子守恒计算消耗硝酸总物质的量,据此解答.
解答 解:m g Fe、Fe3O4、Fe2O3的混合物可以看作Fe、FeO、Fe2O3混合物,用足量H2还原得到Fe与H2O,固体质量减少4.8g为混合物中氧元素质量,氧原子物质的量为$\frac{4.8g}{16g/mol}$=0.3mol,若将等质量的混合物加入足量的稀硝酸中,反应得到Fe(NO3)3,同时产生2.24LNO气体(标准状况下),其物质的量为$\frac{2.24L}{22.4L/mol}$=0.1mol,设Fe、FeO、Fe2O3的物质的量分别为xmol、ymol、zmol,根据氧原子守恒有y+3z=0.3,根据电子转移守恒有:3x+y=0.1×3,整理可得x=z,即Fe、FeO、Fe2O3混合物中Fe、Fe2O3的物质的量之比为1:1,则原混合物可以看作FeO,且n(FeO)=n(O)=0.3mol.
A.根据氧原子守恒:n(H2O)=n(O)=0.3mol,由H原子守恒则n(H2)=n(H2O)=0.3mol,反应中硝酸起氧化剂、酸性作用,根据Fe原子守恒:n[Fe(NO3)3]=n(FeO)=0.3mol,由N原子守恒可知起氧化剂作用的硝酸与NO物质的量相等,故消耗硝酸总物质的量为0.3mol×3+0.1mol=1mol,及参加反应的H2和硝酸的物质的量之比为0.3mol:1mol=3:10,故A错误;
B.由上述分析可知,混合物中氧原子的物质的量为0.3mol,故B正确;
C.由上述分析可知,混合物中铁原子的物质的量为0.3mol,故C正确;
D.由A中计算可知,参加反应的硝酸的物质的量为1mol,故D正确,
故选:A.
点评 本题考查有关混合物反应的计算,关键是通过计算将原混合物转化为单一的FeO进行解答,侧重考查学生分析计算能力,难度较大.


| A. | 结构简式为CH3CCH | B. | 所有原子位于同一平面内 | ||
| C. | 能使酸性高锰酸钾溶液褪色 | D. | 一定条件下,能发生缩聚反应 |
 碳及其化合物的研究具有重要的现实意义
碳及其化合物的研究具有重要的现实意义(1)用电弧法合成的储氢纳米碳管常伴有大量的碳纳米颗粒(杂质),这种颗粒可用如下氧化法提纯:5C+4KMnO4+6H2SO4→5CO2↑+4K2SO4+2MnSO4+6H2O请完成并配平上述化学方程式.
(2)活性炭可处理大气污染物NO.在2L密闭容器中加入NO和活性炭(无杂质),生成气体E和F.当温度分别在T1和T2时,测得各物质平衡时物质的量如下表:
| 物质 T/℃n/mol T/℃ | 活性炭 | NO | E | F |
| 初始 | 2.030 | 0.100 | 0 | 0 |
| T1 | 2.000 | 0.040 | 0.030 | 0.030 |
| T2 | 2.005 | 0.050 | 0.025 | 0.025 |
 N2+CO2.
N2+CO2.②上述反应T1℃时的平衡常数为K1,T2℃时的平衡常数为K2.
Ⅰ.计算K1=0.5625.
Ⅱ.根据上述信息判断,温度T1和T2的关系是(填序号)c.
a.T1>T2 b.T1<T2 c.无法比较
③在T1温度下反应达到平衡后,下列措施不能改变NO转化率的是bc.
a.升高温度 b.增大压强 c.增大c(NO)
(3)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=-1275.6kJ/mol
②2CO (g)+O2(g)=2CO2(g)△H=-566.0kJ/mol
③H2O(g)=H2O(l)△H=-44.0kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-442.8kJ/mol;
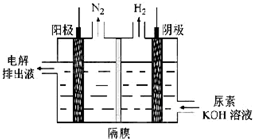
(4)电解尿素[CO(NH2)2]的碱性溶液可以制取氢气,其装置如图所示(电解池中隔膜仅阻止气体通过,阴、阳极均为惰性电极).电解时,阳极的电极反应式为CO(NH2)2+8OH--6e-=CO32-+N2↑+6H2O.
| A. | NaOH | B. | H2SO4 | C. | AgNO3 | D. | Na2SO4 |
| A. | 在化学反应中一定有新物质生成,同时也一定有能量的变化 | |
| B. | 在化学反应中一定有新物质生成,但不一定有能量的变化 | |
| C. | 在化学反应中不一定有化学键的变化 | |
| D. | 在化学反应中一定有化学键的变化,但不一定有能量的变化 |
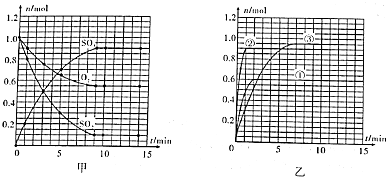
 在一定温度下,将两种气体M和N通入容积为2L的密闭容器中进行反应,M和N的物质的量与时间的关系如图所示.
在一定温度下,将两种气体M和N通入容积为2L的密闭容器中进行反应,M和N的物质的量与时间的关系如图所示.