题目内容
6.(1)下表是在1.013×105Pa下测得的几种物质的沸点:| 结构简式 | 沸点/℃ | 结构简式 | 沸点/℃ |
| CH3CH3 | -88.6 | CH2=CH2 | -103.7 |
| CH3CH2CH3 | -42.2 | CH2=CHCH3 | -47.4 |
| CH3CH2CH2CH3 | -0.5 | CH3CH2CH=CH2 | -6.3 |
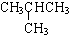 | -11.7 | 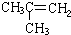 | -6.9 |
| CH3CH2CH2CH2CH3 | 36.1 | CH3CH2CH2CH=CH2 | 30 |
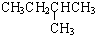 | 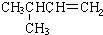 | 20.1 |
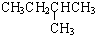 在1.013×105Pa、25℃时的状态是气态(填气态、液态或固态).
在1.013×105Pa、25℃时的状态是气态(填气态、液态或固态).(2)石油裂解是一个复杂的过程,其产物为混合物.例如:
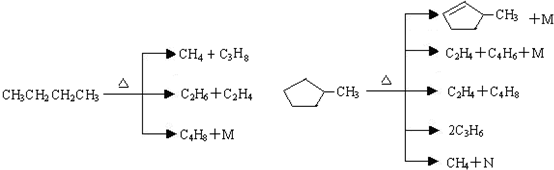
①上述烷烃和环烷烃裂解反应中,产物M的化学式为H2,N的化学式为C5H8.
②下列关于
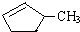 的说法正确的是A.
的说法正确的是A.A.可用溴水区别
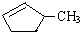 和
和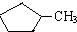
B.等质量的
 和
和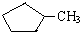 完全燃烧时的耗氧量相同
完全燃烧时的耗氧量相同C.
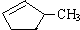 可与水以任意比互溶
可与水以任意比互溶(3)工业上裂解反应的产物都是气态小分子烷烃和烯烃的混合物,将它们逐一分离的方法是降低温度.
分析 (1)由CH3CH2CH2CH=CH2和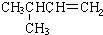 两者为同分异构体,沸点相差大约10,即支链越多,沸点越低判断得出,
两者为同分异构体,沸点相差大约10,即支链越多,沸点越低判断得出,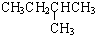 常温下应为气体状态;
常温下应为气体状态;
(2)由图中转化可知,甲基环戊烷生成M,失去2个H,发生氧化反应,则M的化学式为H2,转化为N时,由原子守恒可知N的化学式为C5H8,据此解答即可;
(3)由表格中数据可知,随着碳原子数的增大,烯烃与烷烃的沸点均升高,据此解答即可.
解答 解:(1)CH3CH2CH2CH=CH2和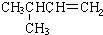 两者为同分异构体,沸点相差大约10,即支链越多,沸点越低判断得出,
两者为同分异构体,沸点相差大约10,即支链越多,沸点越低判断得出,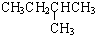 常温下应为气体状态,故答案为:气态;
常温下应为气体状态,故答案为:气态;
(2)①由图中转化可知,甲基环戊烷生成M,失去2个H,发生氧化反应,则M的化学式为H2,转化为N时,由原子守恒可知N的化学式为C5H8,故答案为:H2;C5H8;
②A、含碳碳双键的有机物可使溴水褪色,则可用溴水区别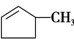 和
和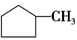 ,故A正确;
,故A正确;
B、等质量的 和
和 ,C原子数相同,但H原子不同,消耗氧气不同,故B错误;
,C原子数相同,但H原子不同,消耗氧气不同,故B错误;
C、 含有碳碳双键,为环烯烃,性质类似与烯烃,应难溶于水,故C错误;
含有碳碳双键,为环烯烃,性质类似与烯烃,应难溶于水,故C错误;
故选A;
(3)由表格中数据可知,随着碳原子数的增大,烯烃与烷烃的沸点均升高,故要得到小分子的烷烃和烯烃,可以通过降低温度实现,故答案为:降低温度.
点评 本题考查有机物的结构与性质,为高频考点,把握转化中结构与官能团的变化为解答的关键,注意官能团与性质的关系、原子守恒的应用,题目难度不大.

练习册系列答案
相关题目
16.香花石被誉为“矿石熊猫”,由我国地质学家首次发现,它由前20号元素中的6种组成,其化学式为X3Y2(ZWR4)3T2,其中X、Y、Z为金属元素,Z的最外层电子数与次外层相等,X、Z位于同族,Y、Z、R、T位于同周期,R最外层电子数是次外层的3倍,T无正价,X与R原子序数之和是W的2倍.下列说法错误的是( )
| A. | 原子半径:Y>Z>R>T | |
| B. | XR2、WR2两化合物中R的化合价相同 | |
| C. | 最高价氧化物对应的水化物碱性:X>Z | |
| D. | 气态氢化物的稳定性:W<R<T |
17.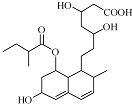 普伐他汀是一种调节血脂的药物,其结构简式如图所示.下列关于普伐他汀的性质描述正确的是( )
普伐他汀是一种调节血脂的药物,其结构简式如图所示.下列关于普伐他汀的性质描述正确的是( )
 普伐他汀是一种调节血脂的药物,其结构简式如图所示.下列关于普伐他汀的性质描述正确的是( )
普伐他汀是一种调节血脂的药物,其结构简式如图所示.下列关于普伐他汀的性质描述正确的是( )| A. | 能与FeCl3 溶液发生显色反应 | |
| B. | 能使溴的CCl4溶液褪色 | |
| C. | 能发生加成、取代、消去反应 | |
| D. | 1 mol 该物质最多可与1 mol NaOH 反应 |
1.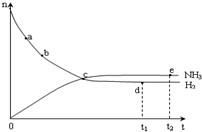 合成氨工业对国民经济和社会发展具有重要的意义.对于密闭容器中的反应:N2(g)+3H2(g)?2NH3(g),673K、30MPa下n(NH3)和n(H2)随时间变化的关系如图所示.下列叙述正确的是( )
合成氨工业对国民经济和社会发展具有重要的意义.对于密闭容器中的反应:N2(g)+3H2(g)?2NH3(g),673K、30MPa下n(NH3)和n(H2)随时间变化的关系如图所示.下列叙述正确的是( )
 合成氨工业对国民经济和社会发展具有重要的意义.对于密闭容器中的反应:N2(g)+3H2(g)?2NH3(g),673K、30MPa下n(NH3)和n(H2)随时间变化的关系如图所示.下列叙述正确的是( )
合成氨工业对国民经济和社会发展具有重要的意义.对于密闭容器中的反应:N2(g)+3H2(g)?2NH3(g),673K、30MPa下n(NH3)和n(H2)随时间变化的关系如图所示.下列叙述正确的是( )| A. | 点a的正反应速率比点b的大 | |
| B. | 点c处反应达到平衡 | |
| C. | 点d(t1时刻) 和点e(t2时刻)处n(N2)不一样 | |
| D. | 点d正反应速率和点 e的逆反应速率一样 |
10. 碳及其化合物的研究具有重要的现实意义
碳及其化合物的研究具有重要的现实意义
(1)用电弧法合成的储氢纳米碳管常伴有大量的碳纳米颗粒(杂质),这种颗粒可用如下氧化法提纯:5C+4KMnO4+6H2SO4→5CO2↑+4K2SO4+2MnSO4+6H2O请完成并配平上述化学方程式.
(2)活性炭可处理大气污染物NO.在2L密闭容器中加入NO和活性炭(无杂质),生成气体E和F.当温度分别在T1和T2时,测得各物质平衡时物质的量如下表:
①请结合上表数据,写出NO与活性炭反应的化学方程式C+2NO N2+CO2.
N2+CO2.
②上述反应T1℃时的平衡常数为K1,T2℃时的平衡常数为K2.
Ⅰ.计算K1=0.5625.
Ⅱ.根据上述信息判断,温度T1和T2的关系是(填序号)c.
a.T1>T2 b.T1<T2 c.无法比较
③在T1温度下反应达到平衡后,下列措施不能改变NO转化率的是bc.
a.升高温度 b.增大压强 c.增大c(NO)
(3)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=-1275.6kJ/mol
②2CO (g)+O2(g)=2CO2(g)△H=-566.0kJ/mol
③H2O(g)=H2O(l)△H=-44.0kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-442.8kJ/mol;
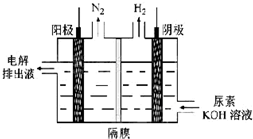
(4)电解尿素[CO(NH2)2]的碱性溶液可以制取氢气,其装置如图所示(电解池中隔膜仅阻止气体通过,阴、阳极均为惰性电极).电解时,阳极的电极反应式为CO(NH2)2+8OH--6e-=CO32-+N2↑+6H2O.
 碳及其化合物的研究具有重要的现实意义
碳及其化合物的研究具有重要的现实意义(1)用电弧法合成的储氢纳米碳管常伴有大量的碳纳米颗粒(杂质),这种颗粒可用如下氧化法提纯:5C+4KMnO4+6H2SO4→5CO2↑+4K2SO4+2MnSO4+6H2O请完成并配平上述化学方程式.
(2)活性炭可处理大气污染物NO.在2L密闭容器中加入NO和活性炭(无杂质),生成气体E和F.当温度分别在T1和T2时,测得各物质平衡时物质的量如下表:
| 物质 T/℃n/mol T/℃ | 活性炭 | NO | E | F |
| 初始 | 2.030 | 0.100 | 0 | 0 |
| T1 | 2.000 | 0.040 | 0.030 | 0.030 |
| T2 | 2.005 | 0.050 | 0.025 | 0.025 |
 N2+CO2.
N2+CO2.②上述反应T1℃时的平衡常数为K1,T2℃时的平衡常数为K2.
Ⅰ.计算K1=0.5625.
Ⅱ.根据上述信息判断,温度T1和T2的关系是(填序号)c.
a.T1>T2 b.T1<T2 c.无法比较
③在T1温度下反应达到平衡后,下列措施不能改变NO转化率的是bc.
a.升高温度 b.增大压强 c.增大c(NO)
(3)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=-1275.6kJ/mol
②2CO (g)+O2(g)=2CO2(g)△H=-566.0kJ/mol
③H2O(g)=H2O(l)△H=-44.0kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-442.8kJ/mol;
(4)电解尿素[CO(NH2)2]的碱性溶液可以制取氢气,其装置如图所示(电解池中隔膜仅阻止气体通过,阴、阳极均为惰性电极).电解时,阳极的电极反应式为CO(NH2)2+8OH--6e-=CO32-+N2↑+6H2O.
11.现有由两种可溶性化合物配成的混合溶液,且浓度均为0.1mol•L-1,其中阳离子可能是Fe2+、Al3+、Fe3+、H+,阴离子可能是NO3-、CO32-、I-、Cl-.若向溶液中加少量盐酸,则溶液变成黄色,且有气体生成.若不计水电离产生的少量离子,则下列说法一定正确的是:( )
| A. | 向溶液中加少量盐酸时,生成的气体可能含有CO2 | |
| B. | 原溶液中一定含有NO3-、Fe2+,一定不含Fe3+、H+、CO32- | |
| C. | 原溶液中一定含有的离子为NO3-,可能含有Fe2+、I- | |
| D. | 若原溶液中逐滴加入NaOH溶液,沉淀的量先增加后减少 |
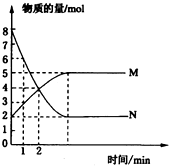 在一定温度下,将两种气体M和N通入容积为2L的密闭容器中进行反应,M和N的物质的量与时间的关系如图所示.
在一定温度下,将两种气体M和N通入容积为2L的密闭容器中进行反应,M和N的物质的量与时间的关系如图所示.