题目内容
5.铝是一种重要的金属,在生产、生活中具有许多重要的用途.眉山市电解铝厂位于三苏故里修文乡,现已经形成年产33万吨电解铝,配套年产15万吨阳极碳块的规模.该厂用铝土矿为原料制备铝的工艺流程如下: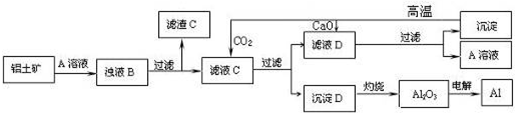
已知:①铝土矿的主要成分是 Al2O3,此外还含有少量CuO、Fe2O3 等杂质.②电解冶炼铝时用碳棒作阳极,用Na3AlF6作助熔剂,电解熔融的Al2O3.
回答下列问题:
(1)写出铝土矿与 A 溶液反应的化学方程式Al2O3+2NaOH=2NaAlO2+H2O.
(2)滤渣 C的主要成分为CuO、Fe2O3;实验室过滤时使用的玻璃仪器有烧杯、漏斗、玻璃棒.
(3)生成过程中,除CaO、H2O可以循环使用外,还可以循环使用的物质有CaCO3、CO2、NaOH(填化学式).
(4)写出过量CO2通入滤液C生成D的离子方程式CO2+AlO2-+2H2O=Al(OH)3↓+HCO3-.
(5)若生产54吨铝,放出平均摩尔质量为36g•mol-1的气体(经测定气体中不含O2),则消耗阳极24吨.
分析 铝土矿的主要成分是Al2O3,此外还含有少量CuO、Fe2O3 等杂质,先用A溶液溶解铝土矿,则A溶液为NaOH溶液,过滤后得到的滤渣C为CuO、Fe2O3;滤液C中溶质为偏铝酸钠;偏铝酸钠溶液中通入二氧化碳气体,反应生成沉淀D氢氧化铝沉淀和滤液D碳酸钠溶液;滤液D中进入氧化钙生成碳酸钙沉淀,过滤后得到碳酸钙沉淀,碳酸钙高温分解生成氧化钙和二氧化碳气体;溶液A中溶质为氢氧化钠;加热沉淀D氢氧化铝分解生成氧化铝,电解氧化铝得到金属铝,
(1)氧化铝与氢氧化钠溶液反应生成偏铝酸钠和水,据此写出反应的离子方程式;
(2)CuO、Fe2O3等杂质不与氢氧化钠溶液反应,过滤后得到的滤渣C为CuO、Fe2O3;根据过滤操作方法判断使用的仪器;
(3)根据用铝土矿为原料制备铝的工艺流程及分析判断可以循环使用的物质;
(4)滤液C中含有偏铝酸钠,偏铝酸钠与二氧化碳反应生成氢氧化铝沉淀和碳酸钠;
(5)产生的气体中不含氧气,放出气体平均摩尔质量为36g•mol-1,说明生成的气体是一氧化碳和二氧化碳的混合物,设一氧化碳的物质的量为x、二氧化碳的物质的量为y,根据电子守恒及平均摩尔质量列式计算出二氧化碳和一氧化碳的物质的量,再利用质量守恒定律计算出C的质量.
解答 解:铝土矿的主要成分是Al2O3,此外还含有少量CuO、Fe2O3 等杂质,先用A溶液溶解铝土矿,则A溶液为NaOH溶液,过滤后得到的滤渣C为CuO、Fe2O3;滤液C中溶质为偏铝酸钠;偏铝酸钠溶液中通入二氧化碳气体,反应生成沉淀D氢氧化铝沉淀和滤液D碳酸钠溶液;滤液D中进入氧化钙生成碳酸钙沉淀,过滤后得到碳酸钙沉淀,碳酸钙高温分解生成氧化钙和二氧化碳气体;溶液A中溶质为氢氧化钠;加热沉淀D氢氧化铝分解生成氧化铝,电解氧化铝得到金属铝,
(1)铝土矿中的氧化铝和氢氧化钠反应生成偏铝酸钠和水,反应的离子方程式为:2OH-+Al2O3═2AlO2-+H2O,
故答案为:2OH-+Al2O3═2AlO2-+H2O;
(2)CuO、Fe2O3不和氢氧化钠溶液反应,过滤得到滤渣为CuO、Fe2O3;过滤操作使用的玻璃仪器有:烧杯、漏斗、玻璃棒,
故答案为:CuO、Fe2O3;烧杯、漏斗、玻璃棒;
(3)根据分析可知,可以循环利用的物质有:CaO、H2O、CaCO3、CO2、NaOH,所以除CaO、H2O可以循环使用外,还可以循环使用的物质有:CaCO3、CO2、NaOH,
故答案为:CaCO3、CO2、NaOH;
(4)滤液C中含有偏铝酸钠,偏铝酸钠与二氧化碳反应的离子方程式为:CO2+AlO2-+2 H2O=Al(OH)3↓+HCO3-,
故答案为:CO2+AlO2-+2 H2O=Al(OH)3↓+HCO3-;
(5)54t铝的物质的量为:$\frac{54×1{0}^{6}}{27g/mol}$=2×106mol,
产生的气体中不含氧气,放出气体平均摩尔质量为36g•mol-1,说明生成的气体是一氧化碳和二氧化碳的混合物,根据电子守恒可知,从氧化铝得到金属铝得到的电子与阳极C与氧气反应生成一氧化碳、二氧化碳时转移电子数相同,
设一氧化碳的物质的量为x、二氧化碳的物质的量为y,则根据电子守恒可得:①2x+4y=2×106mol×3,根据气体平均摩尔质量可得:②$\frac{28x+44y}{x+y}$=36,根据①②可得:x=y=106mol,根据C原子守恒,阳极消耗的C的质量为:12g/mol×(106mol+106mol)=24×106g=24t,
故答案为:24.
点评 本题考查了铝及其化合物的性质,题目难度中等,涉及化学实验基本操作方法的应用、离子方程式的书写、化学计算、铝及其化合物性质等知识,试题知识点较多、综合性较强,充分考查了学生的分析、理解能力及化学实验、化学计算能力.

| A. | Cl2作氧化剂,发生还原反应 | |
| B. | 钾元素化合价降低 | |
| C. | 该反应是置换反应 | |
| D. | 每生成2 mol K2FeO4,转移3 mol电子 |
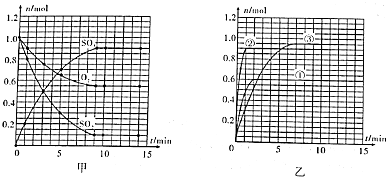
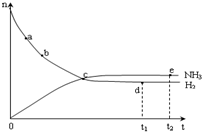 合成氨工业对国民经济和社会发展具有重要的意义.对于密闭容器中的反应:N2(g)+3H2(g)?2NH3(g),673K、30MPa下n(NH3)和n(H2)随时间变化的关系如图所示.下列叙述正确的是( )
合成氨工业对国民经济和社会发展具有重要的意义.对于密闭容器中的反应:N2(g)+3H2(g)?2NH3(g),673K、30MPa下n(NH3)和n(H2)随时间变化的关系如图所示.下列叙述正确的是( )| A. | 点a的正反应速率比点b的大 | |
| B. | 点c处反应达到平衡 | |
| C. | 点d(t1时刻) 和点e(t2时刻)处n(N2)不一样 | |
| D. | 点d正反应速率和点 e的逆反应速率一样 |
 碳及其化合物的研究具有重要的现实意义
碳及其化合物的研究具有重要的现实意义(1)用电弧法合成的储氢纳米碳管常伴有大量的碳纳米颗粒(杂质),这种颗粒可用如下氧化法提纯:5C+4KMnO4+6H2SO4→5CO2↑+4K2SO4+2MnSO4+6H2O请完成并配平上述化学方程式.
(2)活性炭可处理大气污染物NO.在2L密闭容器中加入NO和活性炭(无杂质),生成气体E和F.当温度分别在T1和T2时,测得各物质平衡时物质的量如下表:
| 物质 T/℃n/mol T/℃ | 活性炭 | NO | E | F |
| 初始 | 2.030 | 0.100 | 0 | 0 |
| T1 | 2.000 | 0.040 | 0.030 | 0.030 |
| T2 | 2.005 | 0.050 | 0.025 | 0.025 |
 N2+CO2.
N2+CO2.②上述反应T1℃时的平衡常数为K1,T2℃时的平衡常数为K2.
Ⅰ.计算K1=0.5625.
Ⅱ.根据上述信息判断,温度T1和T2的关系是(填序号)c.
a.T1>T2 b.T1<T2 c.无法比较
③在T1温度下反应达到平衡后,下列措施不能改变NO转化率的是bc.
a.升高温度 b.增大压强 c.增大c(NO)
(3)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=-1275.6kJ/mol
②2CO (g)+O2(g)=2CO2(g)△H=-566.0kJ/mol
③H2O(g)=H2O(l)△H=-44.0kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-442.8kJ/mol;
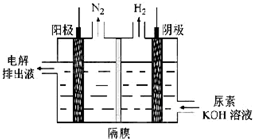
(4)电解尿素[CO(NH2)2]的碱性溶液可以制取氢气,其装置如图所示(电解池中隔膜仅阻止气体通过,阴、阳极均为惰性电极).电解时,阳极的电极反应式为CO(NH2)2+8OH--6e-=CO32-+N2↑+6H2O.
| A. | 氢气球发生爆炸 | B. | 向污染的河水中投放生石灰 | ||
| C. |  | D. | 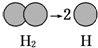 |
| A. | 高分子分离膜应用于食品工业中,可用来浓缩天然果汁、乳制品加工、酿造业等 | |
| B. | 复合材料一般是以一种材料做基体,另一种材料作为增强剂 | |
| C. | 合成高分子材料制成的人工器官一般都受到人体的排斥,难以达到生物相容的程度 | |
| D. | 导电塑料是应用于电子工业的一种新型有机高分子材料 |
 .
.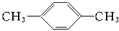 .
. CH3COOCH2CH3+H2O.
CH3COOCH2CH3+H2O.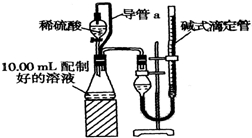 实验室测定碳酸钠和碳酸氢钠混合物中碳酸钠的质量分数W(Na2CO3),称取此混合物5.0g,溶于水中,配成250mL溶液
实验室测定碳酸钠和碳酸氢钠混合物中碳酸钠的质量分数W(Na2CO3),称取此混合物5.0g,溶于水中,配成250mL溶液