题目内容
20. pH=2的A、B两种酸溶液各lmL,分别加水稀释到1000mL,其溶液的pH与溶液体积(V)的关系如图所示,则下列说法正确的是( )
pH=2的A、B两种酸溶液各lmL,分别加水稀释到1000mL,其溶液的pH与溶液体积(V)的关系如图所示,则下列说法正确的是( )| A. | A、B溶液浓度一定相等 | B. | 稀释后A溶液酸性比B溶液强 | ||
| C. | a=5时,A是强酸,B是弱酸 | D. | 若A、B都是弱酸,则2<a=5 |
分析 由图可知,稀释相同的倍数,A的变化大,则A的酸性比B的酸性强,溶液中氢离子浓度越大,酸性越强,对于一元强酸来说c(酸)=c(H+),但对于一元弱酸,c(酸)>c(H+),以此来解答.
解答 解:A.因A、B酸的强弱不同,一元强酸来说c(酸)=c(H+),对于一元弱酸,c(酸)>c(H+),则A、B两种酸溶液的物质的量浓度不一定相等,故A错误;
B.由图可知,B的pH小,c(H+)大,则B酸的酸性强,故B错误;
C.由图可知,若a=5,A完全电离,则A是强酸,B的pH变化小,则B为弱酸,故C正确;
D.若A和B都是弱酸,加水稀释时促进弱酸电离,所以溶液中pH为5>a>2,故D错误.
故选C.
点评 本题考查酸的稀释及图象,侧重于学生的分析能力的考查,明确强酸在稀释时pH变化程度大及酸的浓度与氢离子的浓度的关系是解答本题的关键,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
10. 碳及其化合物的研究具有重要的现实意义
碳及其化合物的研究具有重要的现实意义
(1)用电弧法合成的储氢纳米碳管常伴有大量的碳纳米颗粒(杂质),这种颗粒可用如下氧化法提纯:5C+4KMnO4+6H2SO4→5CO2↑+4K2SO4+2MnSO4+6H2O请完成并配平上述化学方程式.
(2)活性炭可处理大气污染物NO.在2L密闭容器中加入NO和活性炭(无杂质),生成气体E和F.当温度分别在T1和T2时,测得各物质平衡时物质的量如下表:
①请结合上表数据,写出NO与活性炭反应的化学方程式C+2NO N2+CO2.
N2+CO2.
②上述反应T1℃时的平衡常数为K1,T2℃时的平衡常数为K2.
Ⅰ.计算K1=0.5625.
Ⅱ.根据上述信息判断,温度T1和T2的关系是(填序号)c.
a.T1>T2 b.T1<T2 c.无法比较
③在T1温度下反应达到平衡后,下列措施不能改变NO转化率的是bc.
a.升高温度 b.增大压强 c.增大c(NO)
(3)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=-1275.6kJ/mol
②2CO (g)+O2(g)=2CO2(g)△H=-566.0kJ/mol
③H2O(g)=H2O(l)△H=-44.0kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-442.8kJ/mol;
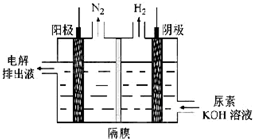
(4)电解尿素[CO(NH2)2]的碱性溶液可以制取氢气,其装置如图所示(电解池中隔膜仅阻止气体通过,阴、阳极均为惰性电极).电解时,阳极的电极反应式为CO(NH2)2+8OH--6e-=CO32-+N2↑+6H2O.
 碳及其化合物的研究具有重要的现实意义
碳及其化合物的研究具有重要的现实意义(1)用电弧法合成的储氢纳米碳管常伴有大量的碳纳米颗粒(杂质),这种颗粒可用如下氧化法提纯:5C+4KMnO4+6H2SO4→5CO2↑+4K2SO4+2MnSO4+6H2O请完成并配平上述化学方程式.
(2)活性炭可处理大气污染物NO.在2L密闭容器中加入NO和活性炭(无杂质),生成气体E和F.当温度分别在T1和T2时,测得各物质平衡时物质的量如下表:
| 物质 T/℃n/mol T/℃ | 活性炭 | NO | E | F |
| 初始 | 2.030 | 0.100 | 0 | 0 |
| T1 | 2.000 | 0.040 | 0.030 | 0.030 |
| T2 | 2.005 | 0.050 | 0.025 | 0.025 |
 N2+CO2.
N2+CO2.②上述反应T1℃时的平衡常数为K1,T2℃时的平衡常数为K2.
Ⅰ.计算K1=0.5625.
Ⅱ.根据上述信息判断,温度T1和T2的关系是(填序号)c.
a.T1>T2 b.T1<T2 c.无法比较
③在T1温度下反应达到平衡后,下列措施不能改变NO转化率的是bc.
a.升高温度 b.增大压强 c.增大c(NO)
(3)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=-1275.6kJ/mol
②2CO (g)+O2(g)=2CO2(g)△H=-566.0kJ/mol
③H2O(g)=H2O(l)△H=-44.0kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-442.8kJ/mol;
(4)电解尿素[CO(NH2)2]的碱性溶液可以制取氢气,其装置如图所示(电解池中隔膜仅阻止气体通过,阴、阳极均为惰性电极).电解时,阳极的电极反应式为CO(NH2)2+8OH--6e-=CO32-+N2↑+6H2O.
11.现有由两种可溶性化合物配成的混合溶液,且浓度均为0.1mol•L-1,其中阳离子可能是Fe2+、Al3+、Fe3+、H+,阴离子可能是NO3-、CO32-、I-、Cl-.若向溶液中加少量盐酸,则溶液变成黄色,且有气体生成.若不计水电离产生的少量离子,则下列说法一定正确的是:( )
| A. | 向溶液中加少量盐酸时,生成的气体可能含有CO2 | |
| B. | 原溶液中一定含有NO3-、Fe2+,一定不含Fe3+、H+、CO32- | |
| C. | 原溶液中一定含有的离子为NO3-,可能含有Fe2+、I- | |
| D. | 若原溶液中逐滴加入NaOH溶液,沉淀的量先增加后减少 |
8.下列说法中正确的是( )
| A. | 在化学反应中一定有新物质生成,同时也一定有能量的变化 | |
| B. | 在化学反应中一定有新物质生成,但不一定有能量的变化 | |
| C. | 在化学反应中不一定有化学键的变化 | |
| D. | 在化学反应中一定有化学键的变化,但不一定有能量的变化 |
15.在下列关于新型有机高分子材料的说法中,不正确的是( )
| A. | 高分子分离膜应用于食品工业中,可用来浓缩天然果汁、乳制品加工、酿造业等 | |
| B. | 复合材料一般是以一种材料做基体,另一种材料作为增强剂 | |
| C. | 合成高分子材料制成的人工器官一般都受到人体的排斥,难以达到生物相容的程度 | |
| D. | 导电塑料是应用于电子工业的一种新型有机高分子材料 |
5.物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合,下列关系式中正确的是( )
| A. | c (Na+)=2c(CH3COO-)+2c(CH3COOH) | B. | c(H+)=c(CH3COO-)+c(OH-) | ||
| C. | c (Na+)>c (CH3COO-)>c(OH-)>c(H+) | D. | c(CH3COO-)+2c(OH-)=2c(H+)+c(CH3COOH) |
12.下列各组物质既不是同系物,也不是同分异构体,但最简式相同是( )
| A. | 1,2-二溴乙烷和1,1-二氯丙烷 | B. | 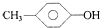 和 和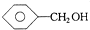 | ||
| C. | CH3CH2CH2COOH和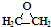 | D. | 丙炔和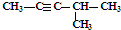 |
9.下列叙述中,正确的是( )
| A. | 化学反应中物质变化的实质是旧化学键的断裂和新化学键的形成 | |
| B. | 离子化合物中一定含有金属元素 | |
| C. | 化学键是物质中原子间强烈的相互作用 | |
| D. | 共价化合物中各原子都一定满足最外层8电子稳定结构 |
10.将某溶液逐滴加入到Fe(OH)3胶体内,开始出现沉淀,继续滴加时沉淀又溶解,该溶液是( )
| A. | 2mol/LH2SO4溶液 | B. | 2mol/LNaOH溶液 | ||
| C. | 2mol/LMgSO4溶液 | D. | 硅酸溶胶(胶体粒子带负电荷) |