题目内容
5.(1)根据有机反应的特点,可将有机反应分为不同的类型.①下列物质不能发生消去反应的是c(填字母).
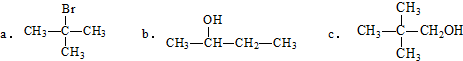
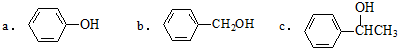
②一定条件下,下列物质能被氧化成醛类物质的是b(填字母).
(2)化合物C 是一种医药中间体,可通过下列方法合成:
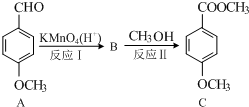
①物质A中至少有12个碳原子处于同一平面内.
②物质C中含氧官能团的名称为酯基、醚基.
③反应Ⅱ的化学方程式为
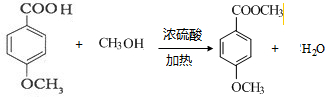 .
.④物质A可在一定条件下,由
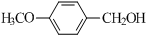 与O2反应制得,写出该反应的化学方程式
与O2反应制得,写出该反应的化学方程式 .
.
分析 (1)①卤代烃、醇发生消去反应,卤素原子、羟基邻位碳原子含有氢原子;
②能被氧化成醛类物质的应为伯醇,含有-CH2OH结构;
(2)A被氧化,-CHO转化为-COOH生成B,则B的结构简式为 ,
, 与甲醇发生酯化反应生成C,
与甲醇发生酯化反应生成C, 在催化作用下发生氧化还原反应生成A,以此解答该题.
在催化作用下发生氧化还原反应生成A,以此解答该题.
解答 解:(1)①卤代烃、醇发生消去反应,卤素原子、羟基邻位碳原子含有氢原子,只有c不能发生消去反应,故答案为:c;
②能被氧化成醛类物质的应为伯醇,含有-CH2OH结构,只有b符合,故答案为:b;
(2)被氧化,-CHO转化为-COOH生成B,则B的结构简式为 ,
,
①A中苯环和醛基都为平面形结构,与苯环直接相连的原子共平面,则至少有12个原子共平面,故答案为:12;
②C中含氧官能团为酯基和醚基,故答案为:酯基、醚基;
③ 与甲醇发生酯化反应生成C,方程式为
与甲醇发生酯化反应生成C,方程式为 ,
,
故答案为: ;
;
④ 在催化作用下发生氧化还原反应生成A,方程式为
在催化作用下发生氧化还原反应生成A,方程式为 ,
,
故答案为: .
.
点评 本题考查以有机物合成考查有机物结构与性质,为高频考点,涉及醛、酚、羧酸性质的考查,把握官能团与性质的关系即可解答,题目难度不大.

练习册系列答案
相关题目
15.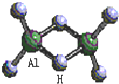 科技日报2007年1月30日讯:美、德两国科学家日前成功合成出具有独特化学特性的氢铝化合物(AlH3)n,其结构类似由硼和氢组成的硼烷,有关研究报告发表在最新出版的美国《科学》杂志上.最简单的氢铝化合物为Al2H6,它的熔点为150℃,燃烧热极高.Al2H6球棍模型如图.下列有关推测肯定不正确的是( )
科技日报2007年1月30日讯:美、德两国科学家日前成功合成出具有独特化学特性的氢铝化合物(AlH3)n,其结构类似由硼和氢组成的硼烷,有关研究报告发表在最新出版的美国《科学》杂志上.最简单的氢铝化合物为Al2H6,它的熔点为150℃,燃烧热极高.Al2H6球棍模型如图.下列有关推测肯定不正确的是( )
 科技日报2007年1月30日讯:美、德两国科学家日前成功合成出具有独特化学特性的氢铝化合物(AlH3)n,其结构类似由硼和氢组成的硼烷,有关研究报告发表在最新出版的美国《科学》杂志上.最简单的氢铝化合物为Al2H6,它的熔点为150℃,燃烧热极高.Al2H6球棍模型如图.下列有关推测肯定不正确的是( )
科技日报2007年1月30日讯:美、德两国科学家日前成功合成出具有独特化学特性的氢铝化合物(AlH3)n,其结构类似由硼和氢组成的硼烷,有关研究报告发表在最新出版的美国《科学》杂志上.最简单的氢铝化合物为Al2H6,它的熔点为150℃,燃烧热极高.Al2H6球棍模型如图.下列有关推测肯定不正确的是( )| A. | Al2H6跟水的反应可能是氧化还原反应,产物之一可能是氢氧化铝 | |
| B. | Al2H6在空气中完全燃烧,产物为氧化铝和水 | |
| C. | Al2H6分子是极性分子 | |
| D. | 氢铝化合物可能成为未来的储氢材料和火箭燃料 |
16.香花石被誉为“矿石熊猫”,由我国地质学家首次发现,它由前20号元素中的6种组成,其化学式为X3Y2(ZWR4)3T2,其中X、Y、Z为金属元素,Z的最外层电子数与次外层相等,X、Z位于同族,Y、Z、R、T位于同周期,R最外层电子数是次外层的3倍,T无正价,X与R原子序数之和是W的2倍.下列说法错误的是( )
| A. | 原子半径:Y>Z>R>T | |
| B. | XR2、WR2两化合物中R的化合价相同 | |
| C. | 最高价氧化物对应的水化物碱性:X>Z | |
| D. | 气态氢化物的稳定性:W<R<T |
13.如图是某烃分子的球棍模型.关于该烃的说法正确的是( )
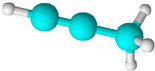

| A. | 结构简式为CH3CCH | B. | 所有原子位于同一平面内 | ||
| C. | 能使酸性高锰酸钾溶液褪色 | D. | 一定条件下,能发生缩聚反应 |
20.高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂.用下面的反应可制取K2FeO4:2Fe(OH)3+3Cl2+10KOH$\frac{\underline{\;0-20℃\;}}{\;}$2K2FeO4+6KCl+8H2O,对于该反应,下列说法正确的是( )
| A. | Cl2作氧化剂,发生还原反应 | |
| B. | 钾元素化合价降低 | |
| C. | 该反应是置换反应 | |
| D. | 每生成2 mol K2FeO4,转移3 mol电子 |
17.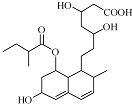 普伐他汀是一种调节血脂的药物,其结构简式如图所示.下列关于普伐他汀的性质描述正确的是( )
普伐他汀是一种调节血脂的药物,其结构简式如图所示.下列关于普伐他汀的性质描述正确的是( )
 普伐他汀是一种调节血脂的药物,其结构简式如图所示.下列关于普伐他汀的性质描述正确的是( )
普伐他汀是一种调节血脂的药物,其结构简式如图所示.下列关于普伐他汀的性质描述正确的是( )| A. | 能与FeCl3 溶液发生显色反应 | |
| B. | 能使溴的CCl4溶液褪色 | |
| C. | 能发生加成、取代、消去反应 | |
| D. | 1 mol 该物质最多可与1 mol NaOH 反应 |
10. 碳及其化合物的研究具有重要的现实意义
碳及其化合物的研究具有重要的现实意义
(1)用电弧法合成的储氢纳米碳管常伴有大量的碳纳米颗粒(杂质),这种颗粒可用如下氧化法提纯:5C+4KMnO4+6H2SO4→5CO2↑+4K2SO4+2MnSO4+6H2O请完成并配平上述化学方程式.
(2)活性炭可处理大气污染物NO.在2L密闭容器中加入NO和活性炭(无杂质),生成气体E和F.当温度分别在T1和T2时,测得各物质平衡时物质的量如下表:
①请结合上表数据,写出NO与活性炭反应的化学方程式C+2NO N2+CO2.
N2+CO2.
②上述反应T1℃时的平衡常数为K1,T2℃时的平衡常数为K2.
Ⅰ.计算K1=0.5625.
Ⅱ.根据上述信息判断,温度T1和T2的关系是(填序号)c.
a.T1>T2 b.T1<T2 c.无法比较
③在T1温度下反应达到平衡后,下列措施不能改变NO转化率的是bc.
a.升高温度 b.增大压强 c.增大c(NO)
(3)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=-1275.6kJ/mol
②2CO (g)+O2(g)=2CO2(g)△H=-566.0kJ/mol
③H2O(g)=H2O(l)△H=-44.0kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-442.8kJ/mol;
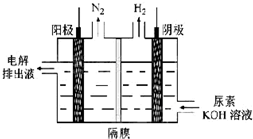
(4)电解尿素[CO(NH2)2]的碱性溶液可以制取氢气,其装置如图所示(电解池中隔膜仅阻止气体通过,阴、阳极均为惰性电极).电解时,阳极的电极反应式为CO(NH2)2+8OH--6e-=CO32-+N2↑+6H2O.
 碳及其化合物的研究具有重要的现实意义
碳及其化合物的研究具有重要的现实意义(1)用电弧法合成的储氢纳米碳管常伴有大量的碳纳米颗粒(杂质),这种颗粒可用如下氧化法提纯:5C+4KMnO4+6H2SO4→5CO2↑+4K2SO4+2MnSO4+6H2O请完成并配平上述化学方程式.
(2)活性炭可处理大气污染物NO.在2L密闭容器中加入NO和活性炭(无杂质),生成气体E和F.当温度分别在T1和T2时,测得各物质平衡时物质的量如下表:
| 物质 T/℃n/mol T/℃ | 活性炭 | NO | E | F |
| 初始 | 2.030 | 0.100 | 0 | 0 |
| T1 | 2.000 | 0.040 | 0.030 | 0.030 |
| T2 | 2.005 | 0.050 | 0.025 | 0.025 |
 N2+CO2.
N2+CO2.②上述反应T1℃时的平衡常数为K1,T2℃时的平衡常数为K2.
Ⅰ.计算K1=0.5625.
Ⅱ.根据上述信息判断,温度T1和T2的关系是(填序号)c.
a.T1>T2 b.T1<T2 c.无法比较
③在T1温度下反应达到平衡后,下列措施不能改变NO转化率的是bc.
a.升高温度 b.增大压强 c.增大c(NO)
(3)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=-1275.6kJ/mol
②2CO (g)+O2(g)=2CO2(g)△H=-566.0kJ/mol
③H2O(g)=H2O(l)△H=-44.0kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-442.8kJ/mol;
(4)电解尿素[CO(NH2)2]的碱性溶液可以制取氢气,其装置如图所示(电解池中隔膜仅阻止气体通过,阴、阳极均为惰性电极).电解时,阳极的电极反应式为CO(NH2)2+8OH--6e-=CO32-+N2↑+6H2O.