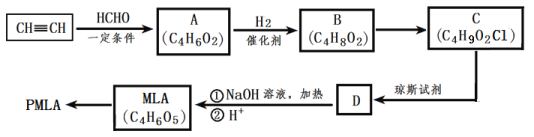
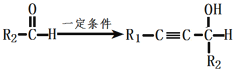
题目内容
【题目】CO、NO、NO2、SO2都是大气污染物,减少这些氧化物排放对于环境保护具有重要的意义。
已知下列热化学方程式
C(s)+O2(g)=CO2(g) ΔH1=-393.5kJ·mol-1
N2(g)+2O2(g)=2NO2(g) ΔH2=+68kJ·mol-1
2C(s)+O2(g)=2CO(g) ΔH3=-221.0kJ·mol-1
(1)2NO2(g)+4CO(g)=4CO2(g)+N2(g)ΔH=__kJ·mol-1。
①某温度下,在2L密闭容器中充入0.4mo1CO和0.6molNO2,此时容器的压强为2.0×105Pa,5s时,容器的压强变为原来的0.95倍,则从反应开始到5秒末NO2的平均反应速率v(NO2)=__mol/(L·s)。
②下列能使该反应的反应速率增大,且平衡向正反应方向移动的是__。
A.适当升高温度
B.减小容器体积使体系压强增大
C.及时分离出CO2
D.向密闭容器中再充入0.4molNO2
(2)某温度下,下列反应的平衡常数如下:
a.2NO2(g)N2(g)+2O2(g) K1=7.0×1016
b.2NO(g)N2(g)+O2(g) K2=2.1×1030
反应2NO(g)+O2(g)2NO2(g)的平衡常数K3=__。
(3)在催化剂作用下用CO还原NO2进行尾气处理。
①相同条件下,选用A、B、C三种催化剂进行反应,生成N2的物质的量与时间变化如图a。活化能最小的是_(用E(A)、E(B)、E(C)表示三种催化剂下该反应活化能)。

②在催化剂B作用下,测得相同时间内,处理NO2的量与温度的关系如图b。图中曲线先增大后减小,请说明后减小的原因___(假设该温度范围内催化效率相同)。

(4)煤燃烧产生的SO2用NaOH溶液吸收,将所得的Na2SO3溶液进行电解,可以制备H2SO4,其原理如图c所示(电极材料为石墨)。a电极反应式为__。b为_(阴、阳)极,d离子交换膜为__(阴、阳)离子交换膜。

【答案】-1200 0.01 BD K3=3.0×1013 E(C) 因正反应为放热反应,300℃已平衡,温度升高平衡逆向移动 SO32--2e-+H2O=SO42-+2H+ 阴 阳
【解析】
(1)已知:①C(s)+O2(g)=CO2(g) ΔH1=-393.5kJ·mol-1,
②N2(g)+2O2(g)=2NO2(g)ΔH2=+68kJ·mol-1,
③2C(s)+O2(g)=2CO(g)ΔH3=-221.0kJ·mol-1,
根据盖斯定律:①×4-③×2-②可得:2NO2(g)+4CO(g)=4CO2(g)+N2(g)ΔH=-1200kJ·mol-1;
①结合题意,设5s末二氧化氮的物质的量变化量为x,列“三段式”,
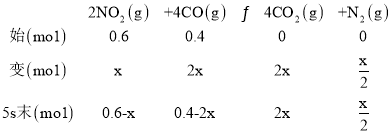
相同条件下物质的量之比等于压强之比,则 ,解得x=0.1mol,因此5秒末NO2的平均反应速率v(NO2)=
,解得x=0.1mol,因此5秒末NO2的平均反应速率v(NO2)=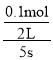 =0.01mol/(L·s);
=0.01mol/(L·s);
②结合(1)计算,正反应放热且气体体积减小的反应,
A.适当升高温度,反应速率增大,但平衡逆向移动,故A不符合题意;
B.减小容器体积使体系压强增大,反应速率加快,平衡向气体体积减小的方向移动,即向正向移动,故B符合题意;
C.及时分离出CO2,生成物浓度减小,平衡正向移动,但反应速率减慢,故C不符合题意;
D.向密闭容器中再充入0.4molNO2,反应正向移动,NO2浓度增大,反应速率加快,故D符合题意;
答案选BD;
(2)已知:a.2NO2(g)N2(g)+2O2(g) K1= =7.0×1016,
=7.0×1016,
b.2NO(g)N2(g)+O2(g) K2=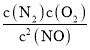 =2.1×1030,
=2.1×1030,
反应2NO(g)+O2(g)2NO2(g)的平衡常数K3=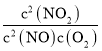 =
=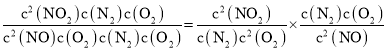 =
=![]() =
=![]() =3×1013;
=3×1013;
(3)①催化剂可以降低活化能,从而使反应速率加快,根据图a分析可得,曲线C反应速率最快,则活化能最低的为E(C);
②300℃时反应达到平衡,该反应为放热反应,300℃之前,随温度升高反应正向进行,处理NO2的量逐渐增多,达到平衡后,处理NO2的量达到最大值,由于反应为放热,继续升高温度平衡逆向移动,处理NO2的量逐渐减少;
(4)将所得的Na2

 学业测评一课一测系列答案
学业测评一课一测系列答案【题目】有U、V、W、X四种前三周期元素,原子序数依次增大,其相关信息如下表:
元素编号 | 相关信息 |
U | 所处的周期数、族序数分别与其原子序数相等 |
V | 外层电子数是最内层电子数的两倍 |
W | 单质中有三对共用电子对 |
X | 是地壳中含量最多的元素 |
请回答下列问题:
(1)U、V两种元素组成的一种化合物甲是重要的化工原料,常把它的产量作为衡量石油化工发展水平的标志,则甲分子的空间构型为________。
(2)写出W单质的结构式 ___________,其化学键为________性共价键:W最简单气态氢化物的电子式为___________,分子的空间构型是___________,其化学键为___________性共价键。
(3)X在周期表中的位置是_______,该主族元素的气态氢化物中,沸点最低的是__________(填化学式)
(4)乙和丙分别是V和X的某种氢化物,这两种氢化物分子中含有有18个电子。乙和丙的化学式分别是________、________。
【题目】元素周期表是指导化学学习的重要工具。下图为元素周期表的一部分。请按要求填空:
N | O | F | |||||
Mg | Al | S | Cl | ||||
(1)N元素形成的单质的电子式_________;N元素的气态氢化物含有化学键属于_______(“离子键”或“共价键”)。
(2)Mg和Al中,金属性较强的是_______(写元素符号),写出一条能说明该结论的事实(用文字描述)___________
(3)S和Cl中,非金属性较强的是___________(写元素符号),不能说明该结论的事实是________(填字母符号)。
a. 单质硫难溶于水,氯气能溶于水
b. ![]() 通入
通入![]() 溶液中,溶液变浑浊
溶液中,溶液变浑浊
c. 受热时![]() 易分解,HCl不易分解
易分解,HCl不易分解
d. 氯气与铁反应生成![]() ,硫与铁反应生成FeS
,硫与铁反应生成FeS
(4)O和S中,非金属性较强的是_________(写元素符号),写出能说明该结论的化学方程式______________