题目内容
【题目】元素周期表是指导化学学习的重要工具。下图为元素周期表的一部分。请按要求填空:
N | O | F | |||||
Mg | Al | S | Cl | ||||
(1)N元素形成的单质的电子式_________;N元素的气态氢化物含有化学键属于_______(“离子键”或“共价键”)。
(2)Mg和Al中,金属性较强的是_______(写元素符号),写出一条能说明该结论的事实(用文字描述)___________
(3)S和Cl中,非金属性较强的是___________(写元素符号),不能说明该结论的事实是________(填字母符号)。
a. 单质硫难溶于水,氯气能溶于水
b. ![]() 通入
通入![]() 溶液中,溶液变浑浊
溶液中,溶液变浑浊
c. 受热时![]() 易分解,HCl不易分解
易分解,HCl不易分解
d. 氯气与铁反应生成![]() ,硫与铁反应生成FeS
,硫与铁反应生成FeS
(4)O和S中,非金属性较强的是_________(写元素符号),写出能说明该结论的化学方程式______________
【答案】![]() 共价键 Mg Mg(OH)2的碱性强于Al(OH)3等 Cl a O 2H2S+O2=2S+2H2O
共价键 Mg Mg(OH)2的碱性强于Al(OH)3等 Cl a O 2H2S+O2=2S+2H2O
【解析】
(1)氮元素形成氮气满足8电子的稳定结构,据此写出电子式;
(2)同周期随原子序数增大元素金属性减弱,可以利用最高价氧化物对应水化物的碱性强弱证明;
(3)同周期随原子序数增大元素非金属性增强,可以根据氢化物稳定、单质之间的相互置换、最高价含氧酸的酸性强弱、与变价金属反应中金属元素的化合价高低等判断,物理性质不能比较非金属性强弱;
(4)同主族自上而下非金属性逐渐减弱;可以根据氢化物稳定、单质之间的相互置换、最高价含氧酸的酸性强弱、与变价金属反应中金属元素的化合价高低等判断;
(1)N元素原子核外有2个电子层、最外层电子数为5,其电子式是![]() ,其气态氢化物是氨气,含有的化学键是共价键,
,其气态氢化物是氨气,含有的化学键是共价键,
故答案为:![]() ;共价键;
;共价键;
(2)同周期随原子序数增大元素金属性减弱,故金属性Mg>Al,氢氧化镁碱性强于氢氧化铝可以证明Mg的金属性比Al强,
故答案为:Mg;氢氧化镁碱性强于氢氧化铝;
(3)同周期随原子序数增大元素非金属性增强,故非金属性Cl>S,
a.单质硫难溶于水,氯气能溶于水,二者的溶解度不同,属于物理性质,不能说明非金属性强弱,故a不能说明;
b.把Cl2通入H2S溶液中能发生置换反应生成S,说明氯气的氧化性比硫强,能说明Cl元素的非金属性强,故b能说明;
c.受热时H2S易分解,HCl不易分解,说明HCl更稳定,能说明Cl的非金属性更强,故c能说明;
d.氯气与铁反应生成FeCl3,硫与铁反应生成FeS,氯化铁中Fe元素化合价比较FeS中的高,说明氯气的氧化性比硫强,能说明Cl元素的非金属性强,,故d能说明;
故答案为:Cl;a。
(4)同主族自上而下非金属性逐渐减弱,O和S中,非金属性较强的是O,可以利用单质间的置换反应证明非金属性强弱,2H2S+O2=2S+2H2O,
故答案为:O ;2H2S+O2=2S+2H2O。

 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案【题目】硫及其化合物有许多用途。相关物质的物理常数如表所示:
H2S | S8 | FeS2 | SO2 | SO3 | H2SO4 | |
熔点/℃ | -85.5 | 115.2 | >600(分解) | 75.5 | 16.8 | 10.3 |
沸点/℃ | -60.3 | 444.6 | -10.0 | 45.0 | 337.0 |
回答下列问题:
(1)基态Fe原子价层电子的电子排布图(轨道表达式)为______,基态S原子电子占据最高能级的电子云轮廓图为______形。
(2)根据价层电子对互斥理论,H2S,SO2,SO3的气态分子中,中心原子价层电子对数不同于其他分子的是______。
(3)图(a)为S8的结构,其熔点和沸点要比二氧化硫的熔点和沸点高很多,主要原因为____。
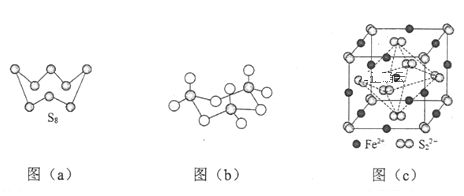
(4)气态三氧化硫以单分子形式存在,其分子的立体构型为______形,其中共价键的类型有______种;固体三氧化硫中存在如图(b)所示的三聚分子。该分子中S原子的杂化轨道类型为______。
(5)FeS2晶体的晶胞如图(c)所示,该晶胞中FeS2个数___________,晶胞边长为anm,FeS2相对式量为M、阿伏加德罗常数的值为NA,其晶体密度的计算表达式为_____g/cm3.(写出表达式) ;晶胞中Fe2+位于S22-所形成的八面体的体心,该正八面体的边长为______nm。
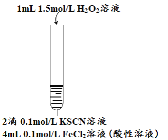
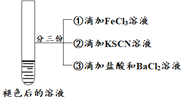
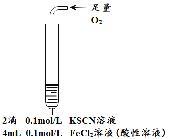
【题目】某小组在Fe2+检验实验中观察到异常现象,为探究“红色褪去”的原因,进行如下实验:
编号 | 实验I | 实验II | 实验III |
实验步骤 |
| 将实验I褪色后的溶液分三份分别进行实验
| 为进一步探究“红色褪去”的原因,又进行以下实验 ① ②取反应后的溶液,滴加盐酸和BaCl2溶液 |
现象 | 溶液先变红,片刻后红色褪去,有气体生成(经检验为O2) | ①无明显现象 ②溶液变红 ③产生白色沉淀 | ①溶液变红,一段时间后不褪色。 ②无白色沉淀产生 |
分析上述三个实验,下列叙述不正确的是
A.在此实验条件下H2O2氧化Fe2+的速率比氧化SCN-的速率快
B.通过实验Ⅱ推出实验Ⅰ中红色褪去的原因是由于SCN-被氧化
C.通过实验Ⅰ和实验Ⅲ对比推出红色褪去只与H2O2的氧化性有关
D.综上所述,实验Ⅰ中红色褪去的原因与化学平衡移动原理无关