题目内容
【题目】0.78克镁铝的混合物投入到25mL30.625%稀硫酸(密度为1.28g/cm3)中,充分反应,在标准状态下得到气体体积0.896L(气体基本上全部收集),在反应后的溶液中加入4mol/L NaOH溶液,使镁离子完全沉淀,铝离子沉淀完全消失.通过计算回答下列问题:
(1)稀硫酸的物质的量浓度为______mol/L
(2)混合物中铝的质量为______。
(3)反应后溶液中加入4mol/L NaOH溶液的体积至少为多少毫升才能使氢氧化铝和氢氧化镁沉淀分开?______。
【答案】4 0.54g 0.54g
【解析】
(1)根据公式![]() ,代入数据可得
,代入数据可得![]() =4mol/L,故答案为:4;
=4mol/L,故答案为:4;
(2)设0.78克混合物中镁、铝的物质的量分别为xmol、ymol,根据质量守恒和电子得失守恒得:![]() ,解之得:
,解之得:![]() ,所以混合物中铝的质量为:0.02×27=0.54 g,故答案为:0.54 g;
,所以混合物中铝的质量为:0.02×27=0.54 g,故答案为:0.54 g;
(3)根据铝原子守恒得n(NaAlO2)=n(Al)=0.02mol,而n(Na2SO4)=n(H2SO4)=4mol/L×25×10﹣3L=0.1mol,所以n(NaOH)=0.02+0.1×2=0.22mol,所以V=![]() =0.055L=55mL,故向反应后溶液中加入4mol/L NaOH溶液的体积至少为55mL。
=0.055L=55mL,故向反应后溶液中加入4mol/L NaOH溶液的体积至少为55mL。

 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案【题目】硫及其化合物有许多用途。相关物质的物理常数如表所示:
H2S | S8 | FeS2 | SO2 | SO3 | H2SO4 | |
熔点/℃ | -85.5 | 115.2 | >600(分解) | 75.5 | 16.8 | 10.3 |
沸点/℃ | -60.3 | 444.6 | -10.0 | 45.0 | 337.0 |
回答下列问题:
(1)基态Fe原子价层电子的电子排布图(轨道表达式)为______,基态S原子电子占据最高能级的电子云轮廓图为______形。
(2)根据价层电子对互斥理论,H2S,SO2,SO3的气态分子中,中心原子价层电子对数不同于其他分子的是______。
(3)图(a)为S8的结构,其熔点和沸点要比二氧化硫的熔点和沸点高很多,主要原因为____。
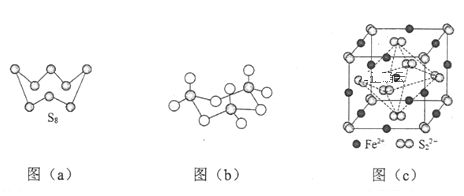
(4)气态三氧化硫以单分子形式存在,其分子的立体构型为______形,其中共价键的类型有______种;固体三氧化硫中存在如图(b)所示的三聚分子。该分子中S原子的杂化轨道类型为______。
(5)FeS2晶体的晶胞如图(c)所示,该晶胞中FeS2个数___________,晶胞边长为anm,FeS2相对式量为M、阿伏加德罗常数的值为NA,其晶体密度的计算表达式为_____g/cm3.(写出表达式) ;晶胞中Fe2+位于S22-所形成的八面体的体心,该正八面体的边长为______nm。