题目内容
【题目】有U、V、W、X四种前三周期元素,原子序数依次增大,其相关信息如下表:
元素编号 | 相关信息 |
U | 所处的周期数、族序数分别与其原子序数相等 |
V | 外层电子数是最内层电子数的两倍 |
W | 单质中有三对共用电子对 |
X | 是地壳中含量最多的元素 |
请回答下列问题:
(1)U、V两种元素组成的一种化合物甲是重要的化工原料,常把它的产量作为衡量石油化工发展水平的标志,则甲分子的空间构型为________。
(2)写出W单质的结构式 ___________,其化学键为________性共价键:W最简单气态氢化物的电子式为___________,分子的空间构型是___________,其化学键为___________性共价键。
(3)X在周期表中的位置是_______,该主族元素的气态氢化物中,沸点最低的是__________(填化学式)
(4)乙和丙分别是V和X的某种氢化物,这两种氢化物分子中含有有18个电子。乙和丙的化学式分别是________、________。
【答案】平面形 N≡N 非极性 ![]() 三角锥形 极性 第二周期ⅥA族 H2S C2H6 H2O2
三角锥形 极性 第二周期ⅥA族 H2S C2H6 H2O2
【解析】
U所处的周期数、族序数分别与其原子序数相等,故U为氢;V元素外层电子数是最内层电子数的两倍,则V为碳元素;W单质中有三对共用电子对,则W为氮元素;X是地壳中含量最多的元素,为O元素,据此分别填空即可。
根据分析可知,U、V、W、X分别为H、C、N、O元素;
(1)H和C形成的化合物,常把它的产量作为衡量石油化工发展水平的标志,故该化合物为乙烯,乙烯中的碳原子采取sp2杂化,为平面型结构;
(2)W的单质为氮气,N原子最外层有5个电子,两个氮原子之间形成三对共用电子对,结构式为N≡N,同种原子间形成的是非极性共价键,W最简单气态氢化物为氨气,氮原子与三个氢原子各形成三对共用电子对,剩余一对孤对电子,电子式为![]() ,氮原子与氢原子形成三对共用电子对,有一对孤对电子,根据价层电子对互斥理论,价层电子对数为4对,VSEPR模型为正四面体,减去一对孤对电子,分子的立体构型为三角锥形,氮原子和氢原子之间形成的共价键为极性共价键;
,氮原子与氢原子形成三对共用电子对,有一对孤对电子,根据价层电子对互斥理论,价层电子对数为4对,VSEPR模型为正四面体,减去一对孤对电子,分子的立体构型为三角锥形,氮原子和氢原子之间形成的共价键为极性共价键;
(3)O在周期表的位置为第二周期ⅥA族,Po是金属,具有放射性,不比较氢化物,该主族元素的气态氢化物H2O、H2S、H2Se、H2Te中,都属于分子晶体,相对分子质量逐渐逐渐增大,沸点随相对分子质量的增大而升高,O形成的氢化物为水,分子间存在氢键,会比H2S的沸点高,沸点最低的是H2S;
(4)碳原子和氧原子与氢原子形成的18个电子,碳原子有6个电子,18除以6得到3,但是由于是氢化物,还应该有氢原子,故分子式为C2H6,氧原子的氢化物有H2O或H2O2,电子数为18的只有H2O2。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】下列研究目的和示意图相符的是( )
选项 | A | B | C | D |
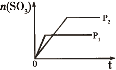
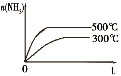
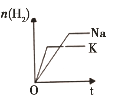
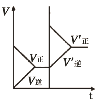
研究目的 | 密闭容器中,压强对反应:2SO2(g)+O2(g) | 固定容积的密闭容器中,温度对反应:N2(g)+3H2(g) | 等质量Na、K分别与足量水反应 | 固定容积的密闭容器中,增大CO2浓度,对已达平衡的反应:CO(g)+H2O(g) |
示意图 |
|
|
|
|
A.AB.BC.CD.D
【题目】硫及其化合物有许多用途。相关物质的物理常数如表所示:
H2S | S8 | FeS2 | SO2 | SO3 | H2SO4 | |
熔点/℃ | -85.5 | 115.2 | >600(分解) | 75.5 | 16.8 | 10.3 |
沸点/℃ | -60.3 | 444.6 | -10.0 | 45.0 | 337.0 |
回答下列问题:
(1)基态Fe原子价层电子的电子排布图(轨道表达式)为______,基态S原子电子占据最高能级的电子云轮廓图为______形。
(2)根据价层电子对互斥理论,H2S,SO2,SO3的气态分子中,中心原子价层电子对数不同于其他分子的是______。
(3)图(a)为S8的结构,其熔点和沸点要比二氧化硫的熔点和沸点高很多,主要原因为____。
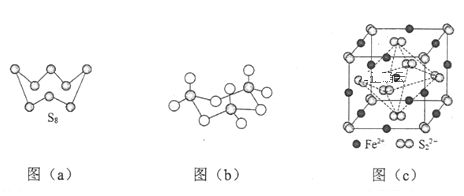
(4)气态三氧化硫以单分子形式存在,其分子的立体构型为______形,其中共价键的类型有______种;固体三氧化硫中存在如图(b)所示的三聚分子。该分子中S原子的杂化轨道类型为______。
(5)FeS2晶体的晶胞如图(c)所示,该晶胞中FeS2个数___________,晶胞边长为anm,FeS2相对式量为M、阿伏加德罗常数的值为NA,其晶体密度的计算表达式为_____g/cm3.(写出表达式) ;晶胞中Fe2+位于S22-所形成的八面体的体心,该正八面体的边长为______nm。