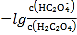��Ŀ����
����Ŀ���������ֳ����£�N2H4����ɫҺ�壩��һ��Ӧ�ù㷺�Ļ���ԭ�ϣ����������ȼ�ϣ��ش��������⣺
��1���������ӵĵ���ʽΪ__��
��2��ʵ���ҿ��ô���������Һ�백��Ӧ�Ʊ���������Ӧ�Ļ�ѧ����ʽΪ��___��
��3����2O2(g)+N2(g)=N2O4(l) ��H1
��N2(g)+2H2(g)=N2H4(l) ��H2
��O2(g)+2H2(g)=2H2O(g) ��H3
д��������N2O4��Ϊ����ƽ�����Ӧ���Ȼ�ѧ����ʽ����H�ú���H1����H2����H3�Ĵ���ʽ��ʾ��___��
���𰸡�![]() NaClO+2NH3=N2H4+NaCl+H2O 2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g) ��H=2��H3-2��H2-��H1
NaClO+2NH3=N2H4+NaCl+H2O 2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g) ��H=2��H3-2��H2-��H1
��������
�������������ַǽ���Ԫ���γɵĹ��ۻ��������ÿ�����1�Ե��ӣ����͵�֮�乲��1�Ե��ӡ�
�ƴ���������Һ�백��Ӧ�Ʊ�������ClԪ�صĻ��ϼ���+1�۽��͵�1�ۣ�NԪ�صĻ��ϼ���3�����ߵ�2�ۣ����ݵ�ʧ�����غ��ԭ���غ���ƽ��
�Ǹ��ݸ�˹���ɣ�2����2���ڢ�����2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g)����H��
�������������ַǽ���Ԫ���γɵĹ��ۻ��������ÿ�����1�Ե��ӣ����͵�֮�乲��1�Ե��ӣ������ʽΪ![]() ���ʴ�Ϊ��
���ʴ�Ϊ��![]() ��
��
�ƴ���������Һ�백��Ӧ�Ʊ�������ClԪ�صĻ��ϼ���+1�۽��͵�1�ۣ�NԪ�صĻ��ϼ���3�����ߵ�2�ۣ����ݵ�ʧ�����غ��ԭ���غ���ƽ����Ӧ�Ļ�ѧ����ʽΪNaClO+ 2NH3 = N2H4+NaCl+H2O���ʴ�Ϊ��NaClO+ 2NH3 = N2H4+NaCl+H2O��
�Ǹ��ݸ�˹���ɣ�2����2���ڢ�����2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g)����H�����Է�Ӧ��ЧӦ֮��Ĺ�ϵʽΪ��H =2��H 32��H2��H1���ʴ�Ϊ��2N2H4(l)+N2O4(l)=3N2(g) + 4H2O(g) ��H=2��H 32��H2��H1��

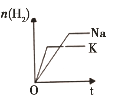
����Ŀ�������о�Ŀ�ĺ�ʾ��ͼ������ǣ� ��
ѡ�� | A | B | C | D |
�о�Ŀ�� | �ܱ������У�ѹǿ�Է�Ӧ��2SO2(g)+O2(g) | �̶��ݻ����ܱ������У��¶ȶԷ�Ӧ��N2(g)+3H2(g) | ������Na��K�ֱ�������ˮ��Ӧ | �̶��ݻ����ܱ������У�����CO2Ũ�ȣ����Ѵ�ƽ��ķ�Ӧ��CO(g)+H2O(g) |
ʾ��ͼ |
|
|
|
|
A.AB.BC.CD.D