��Ŀ����
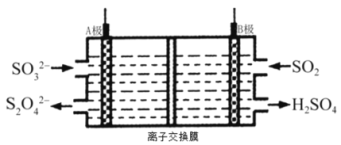
����Ŀ���ۺ�����������PFAS����һ������Чˮ��������������������������Ҫ�ɷ�ΪFe3O4��FeO��SiO2�ȣ�Ϊ��Դ����ú�ң���Ҫ�ɷ�ΪAi2O3�� Fe2O3 ��FeO�ȣ�Ϊ��Դ���Ʊ�PFAS�Ĺ����������£�

��1����������ʱ��Ai2O3������Ӧ�Ļ�ѧ����ʽ____________ ��
��2��������II��ʱ ��Fe3O4������Ӧ�����ӷ���ʽΪ_________
��3��������I����������II���ڱ��������ܼ������õ���________
��4����ȶ�����Ч����ˮ��������Ӱ�졣����ƷPFAS�в���������࣬ʹ��ʱ�����IJ��������________��
���𰸡�Ai2O3+2NaOH=2NaAiO2 + H2O Fe3O4+ 8H+ =2Fe3+ + Fe2+ + 4H2O ������ ��������Ai3+ ��Fe3+ˮ�⣬��������Ч����ˮ���������Ӱ��ˮ��
��������
��ú�ң���Ҫ�ɷ�ΪAl2O3��Fe2O3��FeO�ȣ�������NaOH��ҺʹAl2O3�ܽ⣬�䷽��ʽΪAl2O3+2NaOH=2NaAlO2+H2O���������������������������Ʋ���Ӧ��ͨ�����CO2�������ķ�ӦΪCO2+NaAlO2+2H2O=Al(OH)3��+NaHCO3���ټ���H2SO4ʱ���䷴Ӧԭ��Ϊ2Al(OH)3+3H2SO4=Al2(SO4)3+6H2O���ᾧ�õ�Al2(SO4)3���壻��������������Ҫ�ɷ�ΪFe3O4��FeO��SiO2�ȣ����������������м���H2SO4���䷽��ʽΪFeO+H2SO4=FeSO4+H2O��Fe3O4+8H+=2Fe3++Fe2++4H2O�����������������Ӧ�����������������������Ϊ���Σ��ᾧ���ᾧ���Ʊ�PFAS��
(1)������Ϊ�����������������ʱ��Al2O3������Ӧ�Ļ�ѧ����ʽΪAl2O3+2NaOH=2NaAlO2+H2O��
(2)��������������![]() Ϊ+2��
Ϊ+2��![]() Ϊ+3����������ʱ��Fe3O4������Ӧ�����ӷ���ʽΪFe3O4+8H+=2Fe3++Fe2++4H2O��
Ϊ+3����������ʱ��Fe3O4������Ӧ�����ӷ���ʽΪFe3O4+8H+=2Fe3++Fe2++4H2O��
(3)��������������֪�����������к���Fe2O3��FeO�����������к���SiO2�����ݹ������̣��������ɼ������ã�
(4)PFAS����ˮ������Fe3+��Al3+��Fe3+��Al3+ˮ������������������������������壬�ܾ�ˮ����ȶ�����Ч����ˮ��������Ӱ�죬����ƷPFAS�в������࣬ʹ��ʱ�����IJ�������ǣ���ΪFe3+��Al3+ˮ��������ԣ����Բ�ƷPFAS������������࣬������Al3+��Fe3+ˮ�⣬��������Ч����������ȹ���Ӱ��ˮ�ʡ�

����Ŀ�����������г����Ĺ��̻�������������ѧ�仯����
A.��Ȼ��ȼ�� | B.��Ȼ���ж����ЧӦ | C.�������������� | D.ʳ�׳�ˮ�� |
|
|
|
|
A.AB.BC.CD.D