题目内容
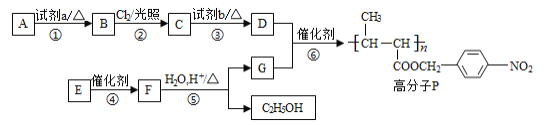
【题目】工业上由煤炭出发制取有机化工原料乙炔,流程如下。回答以下问题:
![]()
(1)由煤炭得到焦炭的工业操作为_____________。
a.分馏 b.干馏 c.裂化 d.裂解
(2)实验室用电石(CaC2)来制备乙炔,反应的化学方程式为:___________。乙炔是一种稍有气味的气体,但实验室制备的乙炔气体具有令人厌恶的刺激性气味,可用某种溶液进行检验,写出检验此气体的化学方程式:___________
(3)乙炔能使溴水褪色,说明乙炔发生_____________反应(反应类型);乙炔能使酸性高锰酸钾褪色,说明乙炔容易被_____________。导电高分子是以聚乙炔为载体的高聚物,写出反应Ⅱ的化学方程式:_____________。
(4)乙炔在一定条件下,三聚得到CH2﹦CH—C≡C—CH﹦CH2:,写出该三聚物具有相同化学式且不易发生加成反应物质的结构简式:_________________。
【答案】b CaC2+2H2O=Ca(OH)2+C2H2↑ H2S+Pb(NO3)2=PbS↓+2HNO3 加成 氧化 n CH≡CH ![]() -[-CH=CH-]-n
-[-CH=CH-]-n 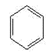
【解析】
煤炭通过干馏得到焦炭,焦炭与氧化钙作用得到CaC2,电石与水反应生成乙炔,含有碳碳三键可以发生加聚反应生成导电高分子。
(1)由煤炭得到焦炭的工业操作为干馏,所以选b;
(2)电石与水反应生成乙炔,方程式为CaC2+2H2O=Ca(OH)2+C2H2↑;电石中常含有CaS等杂质与水反应生成H2S,具有令人厌恶的刺激性气味,可用硝酸铅检验,产生黑色沉淀,方程式为H2S+Pb(NO3)2=PbS↓+2HNO3;
(3)乙炔含有碳碳三键可与溴水发生加成反应使溴水褪色;能使酸性高锰酸钾褪色说明其容易被氧化;乙炔发生加聚反应生成高聚物,方程式为n CH≡CH ![]() -[-CH=CH-]-n;
-[-CH=CH-]-n;
(4)三聚物的分子式为C6H6,具有相同化学式且不易发生加成反应的物质为苯,结构简式为 。
。