题目内容
11.根据题意提示回答有关问题(1)MgCl2的电子式:
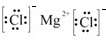
(2)用电子式表示H2O的形成过程:
 .
.(3)磷元素的最高价氧化物的水化物化学式是H3PO4,推测磷元素在氢化物中的化合价是-3.
(4)地壳中含量最高的金属元素在周期表中的位置是:第三周期第ⅢA族
(5)NaOH、Na2O2中均含有的化学键是共价键和离子键.
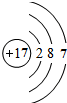
(6)原子序数为17的原子结构示意图:
 ,其最高价氧化物对应的水化物的化学式为HClO4.
,其最高价氧化物对应的水化物的化学式为HClO4.
分析 (1)氯化镁为离子化合物,是由镁离子与2个氯离子通过离子键构成;
(2)氢原子和氧原子之间以共用电子对而形成水分子;
(3)元素最高正价与最低负极绝对值和为8,依据磷酸的分子式推测其最高正价进而求出最低负价;
(4)地壳中含量最高的金属元素为铝,铝原子有3个电子层,最外层有3个电子;
(5)氢氧化钠含有离子键和共价键,过氧化钠含有共价键和离子键;
(6)原子序数为17的原子核外有3个电子层,各层容纳电子数分别为2、8、7,最高正价为+7价.
解答 解:(1)氯化镁为离子化合物,化学式中存在阴阳离子,电子式为: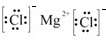 ,故答案为:
,故答案为: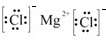 ;
;
(2)氢原子和氧原子之间以共用电子对而形成水分子,用电子式表示形成过程为 ,
,
故答案为: ;
;
(3)由磷元素的最高价氧化物的水化物化学式是H3PO4,可知P的最高正价为+5价,所以其最低负极为-3价,故答案为:-3价;
(4)地壳中含量最高的金属元素为铝,铝原子有3个电子层,最外层有3个电子,在周期表中位于第三周期第ⅢA族,故答案为:第三周期第ⅢA族;
(5)氢氧化钠、过氧化钠都含有离子键和共价键;
故答案为:离子键和共价键;
(6)原子序数为17的原子核外有3个电子层,各层容纳电子数分别为2、8、7,原子结构示意图, ;最高正价为+7价,最高价氧化物对应的水化物的化学式为:HClO4,故答案为:
;最高正价为+7价,最高价氧化物对应的水化物的化学式为:HClO4,故答案为: ;HClO4.
;HClO4.
点评 本题考查了电子式、原子结构示意图的书写,化学键的判断,明确原子结构及电子式书写的方法是解题关键,题目难度不大,注意对基础知识的积累.

练习册系列答案
相关题目
1.下列关于卤素的变化规律不正确的是( )
| A. | 单质的颜色逐渐加深 | B. | 气态氢化物的沸点:HCl>HBr>HI | ||
| C. | 酸性:HF<HCl<HBr<HI | D. | 酸性:HClO4>HBrO4>HIO4 |
2.2014年6月5日为世界环境日,主题为“提高你的呼声而不是海平面”,提倡节能减排,以下措施中不能体现这一思想的是( )
| A. | 提倡绿色生活,使用公共交通 | |
| B. | 大力发展火电,缓解用电紧张 | |
| C. | 开发太阳能、风能、氢能等清洁能源 | |
| D. | 研制出性能优良的催化剂,降低反应所需温度 |
19.下列过程中化学键未被破坏的是( )
| A. | 碘升华 | B. | 溴与H2生成HBr | C. | SO2气体溶于水 | D. | NaCl固体溶于水 |
6.某短周期元素的L层电子数是K层电子数的3倍,该元素的符号为( )
| A. | C | B. | S | C. | O | D. | Si |
16.医学上在对抗癌物质的研究中发现 具有抗癌作用,而
具有抗癌作用,而 没有抗癌作用,对此下列有关叙述正确的是( )
没有抗癌作用,对此下列有关叙述正确的是( )
 具有抗癌作用,而
具有抗癌作用,而 没有抗癌作用,对此下列有关叙述正确的是( )
没有抗癌作用,对此下列有关叙述正确的是( )| A. | 两者互为同分异构体,都是以Pt原子为中心的四面体结构 | |
| B. | 两者互为同分异构体,都是以Pt原子为中心的平面结构 | |
| C. | 两者为同一物质,都是以Pt原子为中心的四面体结构 | |
| D. | 两者为同一物质,都是以Pt原子为中心的平面结构 |
3.原子序数为x的元素位于周期表中的第ⅡA族,则原子序数为x+1的元素不可能为( )
| A. | 第ⅢA族 | B. | 第ⅠA族 | C. | 镧系元素 | D. | 第ⅢB族 |
 工业上制取冰晶石(Na3AlF6)的化学方程式如下:2Al(OH)3+12HF+3A=2Na3AlF6+3CO2↑+9H2O 根据题意完成下列填空:
工业上制取冰晶石(Na3AlF6)的化学方程式如下:2Al(OH)3+12HF+3A=2Na3AlF6+3CO2↑+9H2O 根据题意完成下列填空: .
.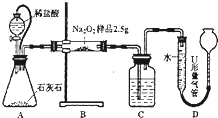 为测定含有Na2O杂质的Na2O2样品的纯度,甲同学设计以下的方案.用如图所示装置,通过测定Na2O2与C02反应生成02的体积来测定样品的纯度.
为测定含有Na2O杂质的Na2O2样品的纯度,甲同学设计以下的方案.用如图所示装置,通过测定Na2O2与C02反应生成02的体积来测定样品的纯度.