题目内容
16.医学上在对抗癌物质的研究中发现 具有抗癌作用,而
具有抗癌作用,而 没有抗癌作用,对此下列有关叙述正确的是( )
没有抗癌作用,对此下列有关叙述正确的是( )| A. | 两者互为同分异构体,都是以Pt原子为中心的四面体结构 | |
| B. | 两者互为同分异构体,都是以Pt原子为中心的平面结构 | |
| C. | 两者为同一物质,都是以Pt原子为中心的四面体结构 | |
| D. | 两者为同一物质,都是以Pt原子为中心的平面结构 |
分析 根据中心原子如果sp3杂化则应是四面体结构,无同分异构现象,而两者的化学性质不同,所以是平面结构.
解答 解:中心原子如果sp3杂化则应是四面体结构,无同分异构现象,而两者的化学性质不同,可知两者分子式相同,但结构不同,两者互为同分异构体,所以是一不同物质,应为平面结构,故选B.
点评 本题考查中心原子的杂化类型和同分异构体的概念,难度中等,充分体现结构决定性质,性质反映结构的理念.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
6.下列物质中既含有共价键又含离子键的化合物是( )
| A. | NaCl | B. | Al2O3 | C. | NaOH | D. | CH4 |
4.现有部分短周期元素的原子结构如下表:
(1)写出X的元素符号:N,Z元素原子的质量数为23.
(2)元素Y的最高价氧化物的结构式为O=C=O,Z元素的单质在空气中燃烧产物的电子式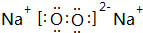 ,用电子式表示X的气态氢化物的形成过程
,用电子式表示X的气态氢化物的形成过程 .
.
(3)Y的最高价氧化物和Z元素的单质在空气中燃烧产物发生反应的化学方程式为2CO2+2Na2O2=2Na2CO3+O2;若反应过程中,转移电子数为6.02×1023,则消耗Y的最高价氧化物的质量为1mol.
| 元素 编号 | 元素原子结构 |
| X | 原子结构示意图为 |
| Y | 最外层电子数是次外层电子数的2倍 |
| Z | 原子核内含有12个中子,且其离子的结构示意图为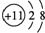 |
(2)元素Y的最高价氧化物的结构式为O=C=O,Z元素的单质在空气中燃烧产物的电子式
 ,用电子式表示X的气态氢化物的形成过程
,用电子式表示X的气态氢化物的形成过程 .
.(3)Y的最高价氧化物和Z元素的单质在空气中燃烧产物发生反应的化学方程式为2CO2+2Na2O2=2Na2CO3+O2;若反应过程中,转移电子数为6.02×1023,则消耗Y的最高价氧化物的质量为1mol.
1.下列关于碱金属的描述正确的是( )
| A. | 碱金属都可以保存在煤油中 | |
| B. | 碱金属元素的单质硬度小、密度小、熔点低 | |
| C. | 在空气中加热均可生成多种氧化物 | |
| D. | 碱金属与水反应,均漂浮在水面上 |
8.X、Y、Z、M、W 为五种短周期元素.X、Y、Z 是原子序数依次递增的同周期元素,且最外层电子数之和为 15,X 与 Z 可形成XZ2分子,Y 与 M 形成的气态化合物在标准状况下的密度为 0.76g/L;W 的质子数是 X、Y、Z、M四种元素质子数之和的1/2.下列说法正确的是( )
| A. | 原子半径:W>Z>Y>X>M | |
| B. | XZ2、X2M2、W2Z2均为共价化合物 | |
| C. | 由Z、M两种元素形成化合物的分子式一定为M2Z | |
| D. | 由 X、Y、Z、M 四种元素形成的化合物可以既有离子键,又有共价键 |
5.下列分子的电子式书写正确的是( )
| A. | 氨 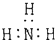 | B. | 四氯化碳 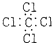 | C. | 氮 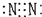 | D. | 二氧化碳 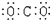 |
6.据报道,${\;}_{67}^{166}$Ho可有效地治疗肝癌,该原子核内的中子数与核外电子数之差为( )
| A. | 32 | B. | 67 | C. | 99 | D. | 166 |

 ;
;
 .
. ,其最高价氧化物对应的水化物的化学式为HClO4.
,其最高价氧化物对应的水化物的化学式为HClO4.