题目内容
1.下列关于卤素的变化规律不正确的是( )| A. | 单质的颜色逐渐加深 | B. | 气态氢化物的沸点:HCl>HBr>HI | ||
| C. | 酸性:HF<HCl<HBr<HI | D. | 酸性:HClO4>HBrO4>HIO4 |
分析 A.卤族元素中,随着原子序数的增大其单质的颜色逐渐加深;
B.卤族元素氢化物中,其相对分子质量与熔沸点成正比,但含有氢键的物质熔沸点最高;
C.元素的非金属性越强,其氢化物的水溶液酸性越弱;
D.元素的非金属性越强,其最高价氧化物的水化物酸性越强.
解答 解:A.卤族元素中,随着原子序数的增大其单质的颜色逐渐加深,从F到I,其单质的颜色分别是浅黄绿色、黄绿色、深红棕色、紫黑色,故A正确;
B.卤族元素氢化物中,其相对分子质量与熔沸点成正比,但含有氢键的物质熔沸点最高,所以熔沸点HCl<HBr<HI,HF中含有氢键,熔沸点最高,故B错误;
C.元素的非金属性越强,吸引电子能力越强,其氢化物在水溶液中越不容易电离出氢离子,所以其氢化物的酸性越弱,则卤族氢化物的水溶液酸性HF<HCl<HBr<HI,故C正确;
D.元素的非金属性越强,其最高价氧化物的水化物酸性越强,非金属性Cl>Br>I,所以酸性:HClO4>HBrO4>HIO4,故D正确;
故选B.
点评 本题考查卤族元素单质、氢化物的稳定性、最高价氧化物的水化物酸性、氢化物的水溶液酸性等性质的判断,明确元素非金属性与其氢化物的稳定性、最高价氧化物的水化物酸性关系即可解答,易错选项是C,注意F元素非金属性最强但HF的水溶液是弱酸.

练习册系列答案
相关题目
9.25℃时,下列各溶液中,离子一定能大量共存的是( )
| A. | 在强碱性溶液中:Na+、K+、AlO2-、Cl- | |
| B. | pH=1的溶液中:HCO3-、NH4+、NO3-、Ca2+ | |
| C. | 无色溶液中:Cu2+、NO3-、Cl-、H+ | |
| D. | 无色溶液中:Na+、K+、ClO-、SO32- |
6.下列物质中既含有共价键又含离子键的化合物是( )
| A. | NaCl | B. | Al2O3 | C. | NaOH | D. | CH4 |
13.以下实验能获得成功的是( )
| A. | 用酸性KMnO4溶液鉴别乙烯和乙炔 | |
| B. | 检验C2H5Cl中氯原子时,将C2H5Cl和NaOH溶液混合加热后,加入稀硫酸进行酸化 | |
| C. | 酒精与稀硫酸加热到170℃制乙烯 | |
| D. | 制取溴苯应用液溴、铁屑和苯混合,反应后并用稀碱液洗涤 |
10.最近科学家研究出一种新的分子,它具有类似足球的空心结构,分子式为12C60,下列有关说法正确的是( )
| A. | 12C60是一种新型化合物 | B. | C60和石墨是碳的同素异形体 | ||
| C. | 12C60具有离子键 | D. | 12C60的摩尔质量是720 |
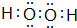 .
.
 .
. ,其最高价氧化物对应的水化物的化学式为HClO4.
,其最高价氧化物对应的水化物的化学式为HClO4.