题目内容
2.2014年6月5日为世界环境日,主题为“提高你的呼声而不是海平面”,提倡节能减排,以下措施中不能体现这一思想的是( )| A. | 提倡绿色生活,使用公共交通 | |
| B. | 大力发展火电,缓解用电紧张 | |
| C. | 开发太阳能、风能、氢能等清洁能源 | |
| D. | 研制出性能优良的催化剂,降低反应所需温度 |
分析 化石燃料的燃烧能排放出大量的二氧化碳,造成空气的污染,故用清洁能源来替代化石能源可以达到节能减排的目的,据此分析.
解答 解:A.提倡绿色生活,使用公共交通,符合节能减排,故A正确;
B.大力发展火电,增加碳的燃烧,增加污染物的排放,故B错误;
C.开发太阳能、风能、氢能等清洁能源,可减少化学能源的使用,符合节能减排,故C正确;
D.降低反应所需温度,符合节能减排,故D正确;
故选B.
点评 本题考查节能减排的相关知识,培养学生的环保意识,难度不大.

练习册系列答案
 步步高达标卷系列答案
步步高达标卷系列答案
相关题目
13.以下实验能获得成功的是( )
| A. | 用酸性KMnO4溶液鉴别乙烯和乙炔 | |
| B. | 检验C2H5Cl中氯原子时,将C2H5Cl和NaOH溶液混合加热后,加入稀硫酸进行酸化 | |
| C. | 酒精与稀硫酸加热到170℃制乙烯 | |
| D. | 制取溴苯应用液溴、铁屑和苯混合,反应后并用稀碱液洗涤 |
10.最近科学家研究出一种新的分子,它具有类似足球的空心结构,分子式为12C60,下列有关说法正确的是( )
| A. | 12C60是一种新型化合物 | B. | C60和石墨是碳的同素异形体 | ||
| C. | 12C60具有离子键 | D. | 12C60的摩尔质量是720 |
17.常温时,下列各组离子能大量共存的是( )
| A. | Ag+、K+、NO3-、Cl- | B. | Fe3+、NH4+、SO42-、NO3- | ||
| C. | Fe2+、Na+、Cl-、ClO- | D. | H+、I-、SO42-、HCO3- |
14.下列各组元素中,按最高正价递增的顺序排列的是( )
| A. | N、O、F | B. | Li、Al、Mg | C. | Li、B、C | D. | Cl、Br、I |
12.a、b、c、d、e、f、g为七种由短周期元素构成的微粒,它们都有10个电子,其结构特点如下:
其中b的离子半径大于e的离子半径;d是溶于水显碱性的四原子分子;c与f作用可生成2个中性分子g.
试写出:
(1)a微粒的原子结构示意图为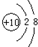
(2)b和e相应元素的最高价氧化物的水化物的碱性强弱比较为:NaOH>Mg(OH)2(用化学式表示).
(3)d的水溶液显碱性的原因(用电离方程式表示)NH3•H2O?NH4++OH-
(4)c微粒是OH-,f微粒是H3O+(用化学式表示).
(5)b相应的元素的单质与g微粒反应的化学方程式为2Na+2H2O=2NaOH+H2↑.
| 微粒代码 | a | b | c | d | e | f | g |
| 原子核数目 | 单核 | 单核 | 双核 | 多核 | 单核 | 多核 | 多核 |
| 带电荷数(单位电荷) | 0 | 1+ | 1- | 0 | 2+ | 1+ | 0 |
试写出:
(1)a微粒的原子结构示意图为
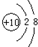
(2)b和e相应元素的最高价氧化物的水化物的碱性强弱比较为:NaOH>Mg(OH)2(用化学式表示).
(3)d的水溶液显碱性的原因(用电离方程式表示)NH3•H2O?NH4++OH-
(4)c微粒是OH-,f微粒是H3O+(用化学式表示).
(5)b相应的元素的单质与g微粒反应的化学方程式为2Na+2H2O=2NaOH+H2↑.

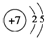 ;
;
 .
.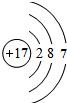 ,其最高价氧化物对应的水化物的化学式为HClO4.
,其最高价氧化物对应的水化物的化学式为HClO4.