题目内容
19.下列过程中化学键未被破坏的是( )| A. | 碘升华 | B. | 溴与H2生成HBr | C. | SO2气体溶于水 | D. | NaCl固体溶于水 |
分析 发生化学反应的物质有旧化学键的断裂和新化学键的形成,溶于水能电离出自由移动离子的物质破坏化学键,熔融态的物质被破坏化学键,以此解答该题.
解答 解:A.碘只是状态的变化,碘的构成微粒是分子,气态的碘构成微粒也是分子,所以化学键未被破坏,故A选;
B.溴和氢气生成溴化氢,发生了化学反应,有化学键的破坏,故B不选;
C.二氧化硫溶于水,二氧化硫和水发生化学反应生成亚硫酸,所以有化学键的破坏,故C不选;
D.氯化钠固体溶于水,氯化钠在水分子的作用下电离出自由移动的阴阳离子,所以化学键被破坏,故D不选.
故选A.
点评 本题考查了化学键是否被破坏的判断,为高频考点,侧重于基本概念的考查,难度不大,易错选项是A,注意状态变化中化学键不一定被破坏.

练习册系列答案
 智慧小复习系列答案
智慧小复习系列答案
相关题目
10.最近科学家研究出一种新的分子,它具有类似足球的空心结构,分子式为12C60,下列有关说法正确的是( )
| A. | 12C60是一种新型化合物 | B. | C60和石墨是碳的同素异形体 | ||
| C. | 12C60具有离子键 | D. | 12C60的摩尔质量是720 |
14.下列各组元素中,按最高正价递增的顺序排列的是( )
| A. | N、O、F | B. | Li、Al、Mg | C. | Li、B、C | D. | Cl、Br、I |
4.现有部分短周期元素的原子结构如下表:
(1)写出X的元素符号:N,Z元素原子的质量数为23.
(2)元素Y的最高价氧化物的结构式为O=C=O,Z元素的单质在空气中燃烧产物的电子式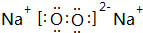 ,用电子式表示X的气态氢化物的形成过程
,用电子式表示X的气态氢化物的形成过程 .
.
(3)Y的最高价氧化物和Z元素的单质在空气中燃烧产物发生反应的化学方程式为2CO2+2Na2O2=2Na2CO3+O2;若反应过程中,转移电子数为6.02×1023,则消耗Y的最高价氧化物的质量为1mol.
| 元素 编号 | 元素原子结构 |
| X | 原子结构示意图为 |
| Y | 最外层电子数是次外层电子数的2倍 |
| Z | 原子核内含有12个中子,且其离子的结构示意图为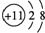 |
(2)元素Y的最高价氧化物的结构式为O=C=O,Z元素的单质在空气中燃烧产物的电子式
 ,用电子式表示X的气态氢化物的形成过程
,用电子式表示X的气态氢化物的形成过程 .
.(3)Y的最高价氧化物和Z元素的单质在空气中燃烧产物发生反应的化学方程式为2CO2+2Na2O2=2Na2CO3+O2;若反应过程中,转移电子数为6.02×1023,则消耗Y的最高价氧化物的质量为1mol.
8.X、Y、Z、M、W 为五种短周期元素.X、Y、Z 是原子序数依次递增的同周期元素,且最外层电子数之和为 15,X 与 Z 可形成XZ2分子,Y 与 M 形成的气态化合物在标准状况下的密度为 0.76g/L;W 的质子数是 X、Y、Z、M四种元素质子数之和的1/2.下列说法正确的是( )
| A. | 原子半径:W>Z>Y>X>M | |
| B. | XZ2、X2M2、W2Z2均为共价化合物 | |
| C. | 由Z、M两种元素形成化合物的分子式一定为M2Z | |
| D. | 由 X、Y、Z、M 四种元素形成的化合物可以既有离子键,又有共价键 |
9.在100mL混合酸的溶液中,硝酸的物质的量浓度为0.4mol/L,硫酸的物质的量浓度为0.2mol/L,向其中加入6.4g铜粉,微热,使其充分反应.生成NO的物质的量( )
| A. | 0.01mol | B. | 0.02mol | C. | 0.03mol | D. | 0.04mol |

 ;
;
 .
. ,其最高价氧化物对应的水化物的化学式为HClO4.
,其最高价氧化物对应的水化物的化学式为HClO4.