题目内容
20. 工业上制取冰晶石(Na3AlF6)的化学方程式如下:2Al(OH)3+12HF+3A=2Na3AlF6+3CO2↑+9H2O 根据题意完成下列填空:
工业上制取冰晶石(Na3AlF6)的化学方程式如下:2Al(OH)3+12HF+3A=2Na3AlF6+3CO2↑+9H2O 根据题意完成下列填空:(1)反应物A的化学式为Na2CO3,属于离子晶体.
(2)生成物中由分子组成的物质属于极性分子的是H2O(写分子式),由分子组成的晶体中熔点较高的是H2O(写分子式),由分子组成的晶体中密度较大的是CO2(写分子式)
(3)反应物中有两种元素在元素周期表中位置相邻,请用一个化学方程式来表示它们的非金属性的大小2F2+2H2O=4HF+O2,并请写出其中电负性较小的元素原子的价层电子排布图:
 .
.(4)制取冰晶石(Na3AlF6)的化学方程式中除氢外,其余原子的第一电离能由大到小的顺序F>O>C>Al>Na
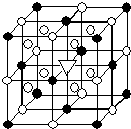
(5)冰晶石(Na3AlF6)是离子化合物,由两种微粒构成,冰晶石晶胞结构如图所示,●位于大立方体顶点和面心,○位于大立方体的12条棱的中点和8个小立方体的体心,那么大立方体的体心处▽所代表的微粒是Na+(填具体的微粒符号).
分析 (1)根据元素守恒知,A中含有Na、C元素,根据原子守恒知,还含有O元素,且Na、C、O原子个数分别是2、1、3,所以A为Na2CO3;由阴阳离子构成的晶体为离子晶体;
(2)分子晶体由分子构成,正负电荷中心不重合的分子为极性分子;分子晶体的熔沸点与分子间作用力有关,氢键导致物质的熔沸点升高;氢键的存在导致冰中空间利用率较低;
(3)反应物中有两种元素在元素周期表中位置相邻,为O、F元素,元素的非金属性越强,其单质的氧化性越强,可以根据非金属单质之间的置换反应判断非金属性强弱;同一周期中,元素的电负性随着原子序数增大而增大,所以F元素电负性大于O元素,O原子最外层电子为其价电子,分别位于2s、2p轨道上;
(4)同一周期元素,元素的第一电离能随着原子序数增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于其相邻元素,同一主族元素中,元素第一电离能随着原子序数增大而减小;
(5)该晶胞中●个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,○个数=12×$\frac{1}{4}$+8=11,根据化学式知,冰晶石中阳离子和阴离子个数之比为3:1,据此判断大立方体的体心处▽所代表的微粒.
解答 解:(1)根据元素守恒知,A中含有Na、C元素,根据原子守恒知,还含有O元素,且Na、C、O原子个数分别是2、1、3,所以A为Na2CO3;由阴阳离子构成的晶体为离子晶体,碳酸钠是由钠离子和碳酸根离子构成的,为离子晶体,故答案为:Na2CO3;离子;
(2)分子晶体由分子构成,正负电荷中心不重合的分子为极性分子,二氧化碳和H2O都是分子晶体,二氧化碳是直线形分子、H2O是V形,二氧化碳中正负电荷中心重合为非极性分子,H2O中正负电荷中心不重合,为极性分子;
分子晶体的熔沸点与分子间作用力有关,氢键导致物质的熔沸点升高,二氧化碳中不含氢键、H2O中含有氢键,所以熔沸点较高的是H2O;
氢键的存在导致冰中空间利用率较低,所以这两种物质中密度较大的是CO2,
故答案为:H2O;H2O;CO2;
(3)反应物中有两种元素在元素周期表中位置相邻,为O、F元素,元素的非金属性越强,其单质的氧化性越强,非金属性较强的单质能置换出非金属较弱的单质,氟气能和水反应置换出氧气,反应方程式为2F2+2H2O=4HF+O2;同一周期中,元素的电负性随着原子序数增大而增大,所以F元素电负性大于O元素,O原子最外层电子为其价电子,分别位于2s、2p轨道上,则O原子价层电子排布图为 ,
,
故答案为:2F2+2H2O=4HF+O2; ;
;
(4)同一周期元素,元素的第一电离能随着原子序数增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于其相邻元素,同一主族元素中,元素第一电离能随着原子序数增大而减小,所以这几种元素第一电离能大小顺序是F>O>C>Al>Na,故答案为:F>O>C>Al>Na;
(5)该晶胞中●个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,○个数=12×$\frac{1}{4}$+8=11,根据化学式知,冰晶石中阳离子和阴离子个数之比为3:1,要使阳离子、阴离子个数之比为3:1,则大立方体的体心处▽所代表的微粒是Na+,
故答案为:Na+.
点评 本题考查晶胞计算、电负性、电离能、原子核外电子排布等知识点,为高考高频点,知道电离能规律及反常现象、构造原理等知识点,注意(2)中氢键的存在影响冰的密度,为易错点.

| A. | 12C60是一种新型化合物 | B. | C60和石墨是碳的同素异形体 | ||
| C. | 12C60具有离子键 | D. | 12C60的摩尔质量是720 |
| A. | 原子半径:W>Z>Y>X>M | |
| B. | XZ2、X2M2、W2Z2均为共价化合物 | |
| C. | 由Z、M两种元素形成化合物的分子式一定为M2Z | |
| D. | 由 X、Y、Z、M 四种元素形成的化合物可以既有离子键,又有共价键 |
| A. | 氨 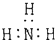 | B. | 四氯化碳 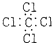 | C. | 氮 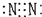 | D. | 二氧化碳 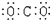 |
| 微粒代码 | a | b | c | d | e | f | g |
| 原子核数目 | 单核 | 单核 | 双核 | 多核 | 单核 | 多核 | 多核 |
| 带电荷数(单位电荷) | 0 | 1+ | 1- | 0 | 2+ | 1+ | 0 |
试写出:
(1)a微粒的原子结构示意图为
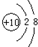
(2)b和e相应元素的最高价氧化物的水化物的碱性强弱比较为:NaOH>Mg(OH)2(用化学式表示).
(3)d的水溶液显碱性的原因(用电离方程式表示)NH3•H2O?NH4++OH-
(4)c微粒是OH-,f微粒是H3O+(用化学式表示).
(5)b相应的元素的单质与g微粒反应的化学方程式为2Na+2H2O=2NaOH+H2↑.
| A. | 0.01mol | B. | 0.02mol | C. | 0.03mol | D. | 0.04mol |
| A. | 常温下,含1 mol Fe的铁片与过量浓HNO3反应,转移电子的数目为3 NA个 | |
| B. | 19.2 g铜与足量的稀硝酸反应产生NO的体积为4.48 L | |
| C. | 标准状况下,33.6 L SO3含有9.03×1023个SO3分子 | |
| D. | 在46 gNO2和N2O4的混合物气体中所含原子总数为3NA个 |

 .
.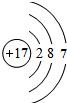 ,其最高价氧化物对应的水化物的化学式为HClO4.
,其最高价氧化物对应的水化物的化学式为HClO4.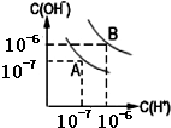 (1)室温下,在pH=12的NaCN溶液中,由水电离的c(OH-)为10-2 mol•L-1.
(1)室温下,在pH=12的NaCN溶液中,由水电离的c(OH-)为10-2 mol•L-1.