题目内容
8.25℃时,有浓度均为0.10mol/L的NaHCO3、AlCl3两种溶液.请回答:(1)两种溶液中,c(H+)<c(OH-)的是NaHCO3(填化学式),其原因是HCO3-+H2O?H2CO3+OH-(用离子方程式表示).
(2)下列关于这两种溶液比较的说法不正确的是①②③(填序号).
①Kw不相等 ②c(Cl-)=c(Na+) ③由水电离出的c(H+)相等
(3)NaHCO3溶液中,离子的浓度由小到大依次为c(H+)<c(OH-)<c(HCO3-)<c(Na+).
(4)两种溶液等体积混合,观察到的现象有白色沉淀产生,并伴有气体逸出.反应的离子方程式Al3++3HCO3-=Al(OH)3↓+3CO2↑.
分析 (1)NaHCO3在溶液中水解显碱性;
(2)①Kw只与温度有关;
②c(Cl-)=0.10mol/L,c(Na+)=0.30mol/L;
③两种物质在水中的水解程度不同;
(3)HCO3-在溶液中部分水解,显碱性;
(4)NaHCO3和AlCl3发生相互促进的水解反应生成氢氧化铝沉淀和二氧化碳.
解答 解:(1)NaHCO3在溶液中水解显碱性,所以其溶液中c(H+)<c(OH-),其水解的离子方程式为:HCO3-+H2O?H2CO3+OH-;
故答案为:NaHCO3;HCO3-+H2O?H2CO3+OH-;
(2)①Kw只与温度有关,与溶液的浓度无关,所以浓度均为0.10mol/L的NaHCO3、AlCl3两种溶液中Kw相同,故错误;
②在0.10mol/L的NaHCO3、AlCl3两种溶液中,c(Cl-)=0.30mol/L,c(Na+)=0.10mol/L,故错误;
③NaHCO3、AlCl3在水中的水解程度不同,对水的电离的促进程度不同,所以两种溶液中由水电离出的c(H+)不相等,故错误;
故答案为:①②③;
(3)HCO3-在溶液中部分水解,显碱性,钠离子不水解,浓度最大,则离子的浓度由小到大依次为c(H+)<c(OH-)<c(HCO3-)<c(Na+);
故答案为:c(H+)<c(OH-)<c(HCO3-)<c(Na+);
(4)NaHCO3和AlCl3发生相互促进的水解反应生成氢氧化铝沉淀和二氧化碳,则反应的现象为有白色沉淀产生,并伴有气体逸出;其反应的离子方程式为:Al3++3HCO3-=Al(OH)3↓+3CO2↑;
故答案为:有白色沉淀产生,并伴有气体逸出;Al3++3HCO3-=Al(OH)3↓+3CO2↑.
点评 本题考查了水的离子积的影响因素、盐类的水解原理及其应用,题目难度中等,注意把握溶液离子浓度大小比较的方法,侧重于考查学生的分析能力和对基础知识的应用能力.

 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案| A | B | C | D |
 |  | 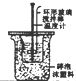 | 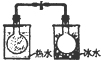 |
| 根据电流表(A)中指针是否偏转即可比较Zn,Cu的金属活泼性 | 根据小试管中液面的变化可判断铁钉发生了析氢腐蚀 | 根据温度计读数的变化测定浓硫酸和NaOH溶液反应的反应热 | 根据两烧瓶中气体颜色的变化(热水中变深、冰水中变浅)判断2NO2(g)?N2O4(g)是吸热反应 |
| A. | A | B. | B | C. | C | D. | D |
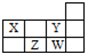
| A. | 1个37W原子中,质子数比中子数多3个 | |
| B. | Y和W处于同一主族,具有相同的最高价态 | |
| C. | Z形成简单阴离子半径小于W形成简单阴离子半径 | |
| D. | X与Y、Z与W每组两种元素间均可形成电子数相等的氢化物 |

| A. | 硫酸溶液的体积为30 mL | |
| B. | b时刻溶液中SO42-的浓度约为0.125 mol•L-1 | |
| C. | d时刻溶液的pH约为13 | |
| D. | 溶液的导电能力:c<d=b<a |
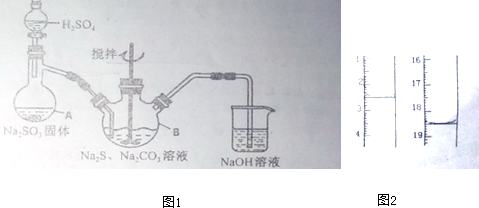
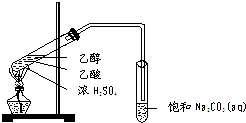 实验室用如图所示的装置制取乙酸乙酯.
实验室用如图所示的装置制取乙酸乙酯. CH3COOC2H5+H2O,乙酸乙酯的密度比水小(填“大”或“小”),有芳香味.
CH3COOC2H5+H2O,乙酸乙酯的密度比水小(填“大”或“小”),有芳香味.