题目内容
19.从含镁、钾盐湖水中蒸发最后得到的产物中含光卤石(xKCl•yMgCl2•zH2O),它在空气中极易潮解、易溶于水,是制造钾肥和提取金属镁的重要原料,其组成可通过下列实验测定:①准确称取5.550g样品溶于水,配成100mL溶液.②将溶液分成二等份,在一份中加人足量的NaOH溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体0.580g.③在另一份溶液中加人足量的硝酸酸化的AgNO3溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体4.305g.(1)步骤②中检验白色固体已洗净的方法是取最后的洗涤液,滴加AgNO3溶液,若不产生沉淀,则已洗净.
(2)已知某温度下Mg(OH)2的Ksp=6.4×10-12,当溶液中c(Mg2+)≤1.0×10-5 mol•L-1可视为沉淀完全,则应保持溶液中c(OH-)≥8×10-4 mol•L-1
(3)通过计算确定样品的组成(写出计算过程)
分析 (1)白色沉淀为氢氧化镁,表面会沾有氯化钾溶液,检验是否洗涤干净的方法是设计实验验证洗涤液中是否含有氯离子;
(2)依据沉淀溶解平衡存在的溶度积常数计算得到;
(3)依据题给条件,结合元素守恒和质量守恒计算氯化镁、氯化钾、水的物质的量得到.
解答 解:(1)白色沉淀为氢氧化镁,表面会沾有氯化钾溶液,检验是否洗涤干净的方法是设计实验验证洗涤液中是否含有氯离子,实验设计为取最后的洗涤液,滴加AgNO3溶液,若不产生沉淀,则已洗净,
故答案为:取最后的洗涤液,滴加AgNO3溶液,若不产生沉淀,则已洗净;
(2)Mg(OH)2的Ksp=6.4×10-12,当溶液中c(Mg2+)≤1.0×10-5mol•L-1可视为沉淀完全,则Ksp=c(Mg2+)×c2(OH-)=6.4×10-12,c(OH-)≥8×10-4mol/L,
故答案为:8×10-4;
(3)5.550 g样品中含:
n(Mg2+)=$\frac{0.58g}{58g/mol}$×2=0.02 mol n(MgCl2)=0.02 mol,
n(Cl-)=$\frac{4.305g}{143.5g/mol}$×2=0.06 mol,
n(KCl)=0.06 mol-2×0.02mol=0.02 mol,
n(H2O)=$\frac{5.550g-0.02mol×95g/mol-0.02mol×74.5g/mol}{18g/mol}$=0.12 mol,
则样品中n(KCl):n(MgCl2):n(H2O)=0.02mol:0.02mol:0.12mol=1:1:6
所以光卤石的化学式为:KCl•MgCl2•6H2O,
答:样品的组成为KCl•MgCl2•6H2O.
点评 本题考查了复杂化学式的计算,题目难度中等,明确反应实质是解题关键,注意掌握质量守恒定律在化学计算中的应用方法,试题侧重考查学生的分析、理解能力及化学计算能力.

| A. | 限制使用电动车 | |
| B. | 利用太阳能、风能和氢能等能源代替化石燃料 | |
| C. | 鼓励私人购买和使用汽车代替公交车 | |
| D. | 以煤等燃料作为主要生活燃料 |
| 元素编号 | 元素性质或原子结构 |
| T | M层的电子数为K层电子数的3倍 |
| X | 其氢化物的空间构型为正四面体 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 元素最高正价是+7价 |
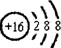 ;元素X的最高价氧化物的电子式
;元素X的最高价氧化物的电子式
(2)元素Y 在周期表中位于二周期,ⅤA族.该元素的最高价氧化物对应水化物与其氢化物能生成盐M,M中含有的化学键类型有离子键、共价键;
(3)四种元素最高价氧化物对应的水化物中酸性最强的是HClO4(填物质化学式)
(4)元素Z与元素T相比,非金属性较强的是Cl(用元素符号表示),下列表述中能证明这一事实的是bce
a.常温下Z的单质和T的单质状态不同
b.Z的氢化物比T的氢化物稳定
c.Z的最高价氧化物所对应的水化物比T的最高价氧化物所对应的水化物的酸性强
d.Z的氢化物比T的氢化物溶解度大
e.Z的单质与H2化合比 T的单质与H2化合更容易
(5)含有34个电子的元素X的氢化物的分子式C4H10
(6)写出实验室制备Z单质的化学方程式:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O
(7)比较T和Z的简单离子的半径大小:S2->Cl-(用元素离子符号表示)
| 选项 | Ⅰ | Ⅱ |
| A | SO2有漂白性 | SO2可使溴水褪色 |
| B | SiO2有导电性 | SiO2可用于制备光导纤维 |
| C | Fe3+有氧化性 | 利用30%的FeCl3溶液腐蚀铜箔制造印刷线路板 |
| D | C12有剧毒 | 大量氯气泄漏时,用烧碱溶液浸湿软布蒙面,并迅速离开现场 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 盐酸 | B. | 无水乙醇 | C. | 石灰水 | D. | H2 |
 CH3COOC2H5+H2O;
CH3COOC2H5+H2O;
 元素及其化合物的学习和应用是中学化学的主要任务之一.
元素及其化合物的学习和应用是中学化学的主要任务之一.